题目内容
【题目】25℃时,在0.1mol/L的草酸(H2C2O4)溶液中加入等浓度的NaOH溶液,H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的变化如图所示。下列说法不正确的是

A. 反应过程中c(H2C2O4)+c(HC2O4-)+c(C2O42-)<0.1mol/L
B. lg[K1(H2C2O4)]=-1.2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
D. 当NaOH溶液与H2C2O4溶液体积之比为3:2时,2c(Na+)+c(OH-)=2c(H2C2O4)+c(HC2O4-)+c(H+)
【答案】D
【解析】
A.反应过程中溶液体积增大,故c(H2C2O4)+c(HC2O4-)+c(C2O42-)<0.1mol/L,故A正确;
B.根据交点(1.2,0.5)计算,K1=10-12,故lg[K1(H2C2O4)]=-1.2,故B正确;
C.根据交点(4.2,0.5)计算,K2=10-4.2,Kh(HC2O4-)=10-12,在NaHC2O4溶液中,HC2O4-的电离程度大于水解程度,故c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故C正确;
D.当V(NaOH溶液):V(H2C2O4溶液)=3:2时,物料守恒为2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-),电荷守恒为c(Na+)+c(OH-)=3c(H2C2O4)+2c(HC2O4-)+c(H+)+c(C2O42-),故D错误,
故选D。

【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
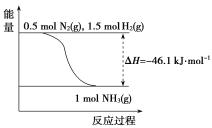
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
【题目】甲烷、乙烯是两种重要的有机化合物,回答下列问题:
(1)工业上以乙烷(C2H6)为原料,用传统的热裂解法或现在的氧化裂解法制取乙烯:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136kJ/mol;
②2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ΔH2=-220kJ/mol
已知上述反应中部分化学键键能数据如下表:
化学能 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | a | 496 |
由此计算a=_________。
(2)甲烷可用于消除氮氧化物NO2:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
温度 | 物质的量 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
①温度为T1时,0—10min内NO2的平均反应速率v(NO2)=__________________。
②根据表中数据判断T1 _________T2(填“>”“<”或“=”),当温度为T2时反应进行到40min时,x_______0.15(填“>”“<”或“=”),该反应为_________(填“放热”或“吸热”)反应。
③单位时间内形成C—H键与形成C==O氧键的数目之比为_________时,说明反应达到平衡状态。
④温度为T2时,若相平衡后的容器中再充入0.5molCH4和1.2molNO2,重新达到平衡时,n(N2)的范围是__________________。
(3)甲烷、乙烯完全燃烧均生成CO2,常温下H2CO3![]() H++HCO3- Ka1=4.3×10-7;HCO3-
H++HCO3- Ka1=4.3×10-7;HCO3-![]() H++CO3-2- Ka2=5.6×10-11;NH3·H2O
H++CO3-2- Ka2=5.6×10-11;NH3·H2O![]() NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显_________(填“酸性”“碱性”或“中性”),计算反应NH4++HCO3-+H2O
NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显_________(填“酸性”“碱性”或“中性”),计算反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(结果保留小数点后1位)
NH3·H2O+H2CO3的平衡常数K=_________(结果保留小数点后1位)

