题目内容
【题目】已知如表数据。
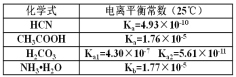
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)=_____molL-1。
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为_____。
(3)0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是_____(填化学式)。
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____。
(5)25℃1.10molL-1CH3COOH溶液中,CH3COOH的电离度约为_____。
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl_____NaCN(填“大于”、“小于”或“等于”);
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈_____性(填“酸”“碱”或“中”)。
【答案】10-3 Na2CO3>NaCN>CH3COONa NH4+ NaCN+H2O+CO2=NaHCO3+HCN 0.4% 大于 中
【解析】
根据溶液的pH及水的离子积计算溶液中水电离的氢离子浓度;根据电离常数的大小分析比较溶液的酸碱性;根据盐类水解原理分析解答;根据弱酸的电离平衡常数计算电离度;根据溶液中守恒关系分析比较离子浓度大小。
(1)pH=11的NaCN溶液,c(H+)=10-11molL-1,Kw=c(H+)×c(OH-)=10-14,故c(OH-)=10-3molL-1,氢氧根离子来源于水的电离,故c(OH-)水=10-3molL-1,故答案为:10-3;
(2)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH:Na2CO3溶液>NaCN溶液>CH3COONa溶液;故答案为:Na2CO3>NaCN>CH3COONa;
(3)铵根离子水解而导致其溶液呈酸性,碳酸氢根离子水解使溶液呈碱性,根据电离常数可知碳酸氢根离子的水解能力大于铵根离子, NH4HCO3溶液呈碱性;碳酸氢根离子水解程度大于铵根离子,故溶液中离子浓度最大的是NH4+,故答案为: NH4+;
(4)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成碳酸钠,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)1.10mol/L的CH3COOH溶液中,CH3COOH的电离常数Ka=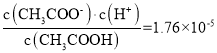 ,醋酸根离子和氢离子浓度相等,所以
,醋酸根离子和氢离子浓度相等,所以![]() ,CH3COOH的电离度约
,CH3COOH的电离度约![]() ,故答案为:0.4%;
,故答案为:0.4%;
(6)根据电荷守恒分析知,等体积等浓度的NaCl与NaCN两溶液中,离子总数都等于阳离子总数的二倍,两溶液中的钠离子不水解,所以数目相同,NaCl溶液呈中性,则c(H+)=10-7mol/L,NaCN溶液呈碱性,则c(H+)<10-7mol/L,则离子总数NaCl大于NaCN,故答案为:大于;
(7)HCN与NaOH反应后的溶液中存在电荷守恒:c(Na+)+ c(H+)=c(CN-)+c(OH-),若c(Na+)=c(CN-),则c(H+)= c(OH-),该溶液呈中性,故答案为:中。