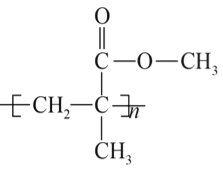
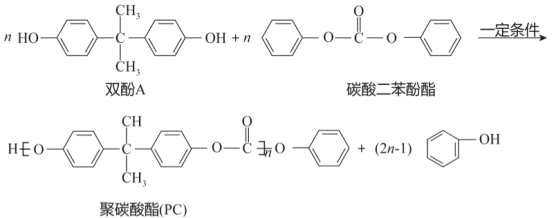
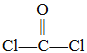题目内容
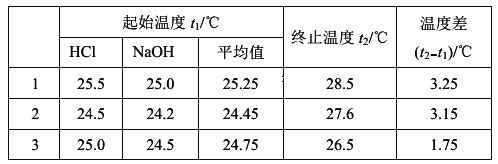
【题目】常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
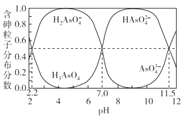
A. H3AsO4的第一步电离常数Ka1>0.01
B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0
C. 0.1mol·L-1H3AsO4溶液的pH<2
D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
【答案】C
【解析】A项,H3AsO4第一步电离方程式为H3AsO4![]() H++H2AsO4-,Ka1= [c(H+)·c(H2AsO4-)]/c(H3AsO4),由图可知当H2AsO4-与H3AsO4相等时pH=2.2,c(H+)=10-2.2mol/L,则Ka1=c(H+)=10-2.2=0.0063
H++H2AsO4-,Ka1= [c(H+)·c(H2AsO4-)]/c(H3AsO4),由图可知当H2AsO4-与H3AsO4相等时pH=2.2,c(H+)=10-2.2mol/L,则Ka1=c(H+)=10-2.2=0.0063![]() 0.01,错误;B项,H3AsO4属于弱酸,任何pH下溶液中的含As微粒都有H3AsO4、H2AsO4-、HAsO42-、AsO43-,由图知pH=7.0时,溶液中主要含As微粒为H2AsO4-、HAsO42-,溶液中c(AsO43-)、c(H3AsO4)都很小但不等于0,错误;C项,多元弱酸在溶液中分步电离且第一步电离
0.01,错误;B项,H3AsO4属于弱酸,任何pH下溶液中的含As微粒都有H3AsO4、H2AsO4-、HAsO42-、AsO43-,由图知pH=7.0时,溶液中主要含As微粒为H2AsO4-、HAsO42-,溶液中c(AsO43-)、c(H3AsO4)都很小但不等于0,错误;C项,多元弱酸在溶液中分步电离且第一步电离![]() 第二步电离
第二步电离![]() 第三步电离,溶液中H+主要来自第一步电离,溶液中c(H+)
第三步电离,溶液中H+主要来自第一步电离,溶液中c(H+)![]() c(H2AsO4-),c(H3AsO4)=0.1mol/L-c(H2AsO4-)
c(H2AsO4-),c(H3AsO4)=0.1mol/L-c(H2AsO4-)![]() 0.1mol/L-c(H+),Ka1=[c(H+)·c(H2AsO4-)]/c(H3AsO4)=c2(H+)/[0.1mol/L-c(H+)]=10-2.2,解得c(H+)=10-1.65,溶液pH=1.65
0.1mol/L-c(H+),Ka1=[c(H+)·c(H2AsO4-)]/c(H3AsO4)=c2(H+)/[0.1mol/L-c(H+)]=10-2.2,解得c(H+)=10-1.65,溶液pH=1.65![]() 2,正确;D项,常温下pH=12,溶液呈碱性,c(H+)
2,正确;D项,常温下pH=12,溶液呈碱性,c(H+)![]() c(OH-),错误;答案选C。
c(OH-),错误;答案选C。

【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。