��Ŀ����
����Ŀ���Ĵ���֦���̲طḻ�ķ����ѡ�����Դ����������������Ҫ�ɷ�ΪTiO2��FeO��Fe2O3��Ti������ϼ�Ϊ+4����ԭ�ϣ�������ɫ���϶������ѵ���Ҫ�������£�
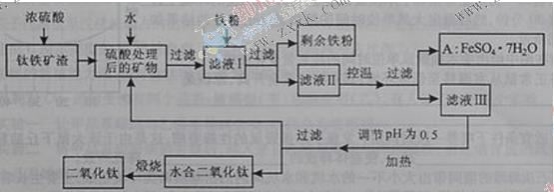
��ش��������⣺
��1��������������ѷ�Ӧ�Ļ�ѧ����ʽ��____________________________________��
��2������ҺI�м������ۣ�������Ӧ�����ӷ���ʽΪ��_________________________��_______________________________________��
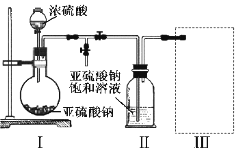
��3����ʵ�����������У����ˮ�м�����Һ��ʹ���ҺpH��0.5�����ο�ʼˮ�⡣ˮ������в���ͨ�����ˮ������ά����Һ����һ��ʱ�䣬���γ��ˮ������ˮ�϶������ѳ�����������ѧ��ѧƽ��ԭ������ͨ�����ˮ���������ã�_______________________________________________��
���˷����ˮ�϶������ѳ�������Һ���ص���ҪĿ���dz��������Һ�е����Ρ�___________��______________��_______________________���ѧʽ�������ٷ����ŷš�
��4��A������������ɫ���ϣ�Fe2O3�����䷽���ǣ���556a kg A��Ħ������Ϊ278 g/mol������ˮ�У�������������������Һǡ����ȫ��Ӧ�����������������裬�������ɫ���壻������ɫ�����м���3336b kg A��112c kg���ۣ����������������裬��Ӧ��ɺ��д���Fe2O3�����ڽ����������Գ�����ʽ���������˺������������յú�ɫ���ϡ���������Һ������ֻ�������ƺ����������������Ͽ�������ɫ����_______________________kg��
���𰸡�![]() ��
��![]()
![]()
![]() ��ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����
��ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����![]() Ũ�ȴٽ�����ˮ��
Ũ�ȴٽ�����ˮ�� ![]()
![]()
![]()
![]()
��������
������������Ҫ�ɷ�ΪTiO2��FeO��Fe2O3������Ũ���ᣬTiO2��FeO��Fe2O3��Ũ���ᷴӦ�����������Σ���ˮ�����Һ������Ҫ��Ti(SO4)2��FeSO4��Fe2(SO4)3������������ۿɺ�Fe2(SO4)3��Ӧ����FeSO4���ٹ��ˣ��õ�����Һ���е�FeSO4����ͨ������Ũ������ȴ�ᾧ��FeSO4��7H2O��ʽ��������Һ�������Һ��pH��ʹ������ˮ��õ�ˮ�϶������ѣ����յõ��������ѡ�
��1��������������ѷ������ֽⷴӦ����ѧ����ʽ��![]() ��
��
��2������ҺI�м������ۣ���ҺI�е�H+��Fe3+�����Ժ���������Ӧ�����ӷ���ʽΪ��![]() ��
��![]() ��
��
��3��ˮ�������ȵģ�����ˮ����ʹˮ��ƽ�������ƶ���������ˮ������в���ͨ�����ˮ���������γ��ˮ������ˮ�϶������ѳ��������˷����ˮ�϶������ѳ�������Һ�е����Ρ�H2O��FeSO4��H2SO4������ѭ�����á��ʴ�Ϊ����ˮ�ٽ�����ˮ�⣬���ȴٽ�����ˮ�⣬����![]() Ũ�ȴٽ�����ˮ�⣬H2O��FeSO4��H2SO4��
Ũ�ȴٽ�����ˮ�⣬H2O��FeSO4��H2SO4��
��4��556a kg FeSO4��7H2O�����ʵ���Ϊ2a��103mol����������������Һǡ����ȫ��Ӧ�����Լ����NaOH�����ʵ���4a��103mol���������ɫ����Fe(OH)3���ټ���3336b kg FeSO4��7H2O(12b��103mol)��112c kg(2c��103mol)���ۡ�������Һ������ֻ�������ƺ���������Na+Ϊ4a��103mol��SO42-Ϊ4a��103mol+12b��103mol�����ݵ���غ㣬��Һ�е�Fe3+Ϊ8b��103mol����Fe2O3�е�����2a��103mol+(12b��103mol -8b��103mol)+2c��103mol������Fe2O3�����ʵ���Ϊa��103mol+2b��103mol+c��103mol��Fe2O3������Ϊ160(a��103mol+2b��103mol+c��103mol)g=![]() kg��
kg��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д�