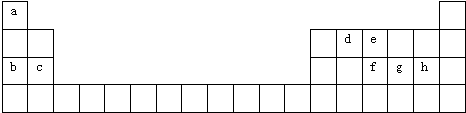
题目内容
4.下列化合物,既能与强酸反应,又能与强碱溶液反应的是( )①Al(OH)3 ②NaHCO3 ③(NH4)2S ④NaHSO4.
| A. | 只有① | B. | ①和② | C. | ①②③ | D. | ①②③④ |
分析 Al、Al2O3、Al(OH)3、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和强酸、强碱反应,据此分析解答.
解答 解:①Al(OH)3属于两性氢氧化物,能和强酸、强碱反应生成盐和水,故正确;
②NaHCO3属于弱酸酸式盐,能和强酸、强碱反应生成盐,故正确;
③(NH4)2S属于弱酸的铵盐,能和强酸、强碱反应,故正确;
④NaHSO4属于强酸酸式盐,其溶液呈强酸性,能和强碱反应,但和强酸不反应,故错误;
故选C.
点评 本题考查能和强酸、强碱反应的物质,侧重考查学生分析及知识运用能力,注意总结归纳知识点,熟悉常见物质的性质,注意氧化铝、氢氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
15.下列热化学方程式中的反应热下划线处表示燃烧热的是( )
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 0.1 molCH2=CH-COOH中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和乙烯组成的56 g混合气体中氢原子的个数为8NA |
19.某有机物的氧化产物甲和还原产物乙都能与金属钠反应放出H2,甲、乙反应可生成丙,甲、丙都能发生银镜反应,此有机物是( )
| A. | 甲醛 | B. | 乙醛 | C. | 甲酸 | D. | 乙酸 |
9.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示.关于咖啡鞣酸的下列说法正确的是( )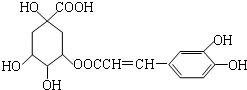
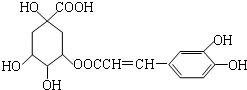
| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 咖啡鞣酸分子中所有原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
16. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
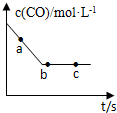
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
①实验编号Ⅱ的实验目的为探究催化剂比表面积对反应速率的影响.
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
13.下列各溶液中,离子一定能大量共存的是( )
| A. | NH4+、Fe2+、NO3-、H+ | B. | K+、Mg2+、I-、ClO- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、HCO3-、Cl-、H+ |
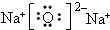 .
.