题目内容
20. 将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )
将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )①试管内黄绿色逐渐消失 ②试管内黄绿色加深
③无任何现象④试管内液面上升⑤试管内壁上有油状物生成.
| A. | ① | B. | ①④和⑤ | C. | ①和⑤ | D. | ②和⑤ |
分析 甲烷与氯气在光照条件下发生取代反应生成甲烷的氯代烃和氯化氢,所以气体颜色逐渐变浅,由于生成的氯化氢极易溶于水,所以试管中液面上升;生成的一氯甲烷为气体,其它氯代产物为不溶于水的液体,所以试管内壁有油状物质生成,据此进行解答.
解答 解:①,由于反应物和生成物中只有氯气为有色物质,在光照条件下氯气与甲烷发生了反应,所以试管内气体颜色逐渐变浅,故①正确;
②由于氯气与甲烷发生反应,所以试管中气体颜色变浅,故②错误;
③根据①分析可知,试管中气体的颜色会逐渐变浅,故③错误;
④氯气与甲烷反应生成各种氯代产物和氯化氢,氯化氢极易溶于水,试管中气体体积减小,所以试管内液面上升,故④正确;
⑤反应生成的二氯甲烷、三氯甲烷和四氯化碳为不溶于水的油状液体,所以试管内壁上有油状物生成,故⑤正确;
故选B.
点评 本题考查了甲烷的取代反应,题目难度不大,注意掌握常见的分子组成、结构与具有的化学性质,明确甲烷与氯气发生取代反应的现象是解答本题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
8.下列排序正确的是( )
| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
5.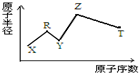 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
12.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-?H++A2-,关于下列说法不正确的是( )
| A. | NaHA的水溶液可能呈酸性,也可能呈碱性 | |
| B. | 0.1mol•L-1Na2A溶液中,c(A2-)+c(HA-)=0.1 mol•L-1 | |
| C. | NaHA的水溶液中离子浓度关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | Na2A的水溶液中:c(Na+)=2c(HA-)+2c(A2-) |
9.已知氮元素和氧元素组成的化合物中 氮元素和氧元素的质量比为7:16其化学式可能为( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O5 |
10.20℃时,NaCl溶解于水的实验数据如下表所示
下列叙述正确的是( )
| 实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
| ① | 10 | 2 | 0 |
| ② | 10 | 3 | 0 |
| ③ | 10 | 4 | 0.4 |
| A. | 实验①所得的溶液为饱和溶液 | |
| B. | 实验②所得的溶液为饱和溶液 | |
| C. | 20℃时NaCl的溶解度为30g | |
| D. | 实验①所得溶液的溶质质量分数为16.7% |
 转化为对甲基苯乙炔
转化为对甲基苯乙炔 的合成路线流程图如下:
的合成路线流程图如下:
 ,③的反应类型为加成反应.
,③的反应类型为加成反应.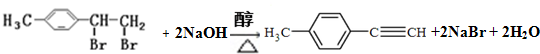 .
.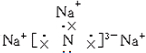 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.