题目内容
8.下列排序正确的是( )| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
分析 A、CH3COOH的酸性强于碳酸的酸性,碳酸的酸性强于苯酚,苯酚的酸性强于碳酸氢根离子的酸性;
B、金属性越强最高价氧化物对应的水化物的碱性越强;
C、不同类别的晶体熔点一般是原子晶体大于离子晶体,离子晶体大于分子晶体;
D、而F的半径比N小这就使得特排的更紧密,F的电负性也大所以HF的沸点应该比NH3,而磷化氢分子间是分子间作用力.
解答 解:A、CH3COOH的酸性强于碳酸的酸性,碳酸的酸性强于苯酚,苯酚的酸性强于碳酸氢根离子的酸性,所以酸性:C6H5OH<H2CO3<CH3COOH,故A错误;
B、金属性越强最高价氧化物对应的水化物的碱性越强,金属性Ba>Ca,但氢氧化钙为溶于水,所以碱性Ca(OH)2<Ba(OH)2,故B错误;
C、不同类别的晶体熔点一般是原子晶体大于离子晶体,离子晶体大于分子晶体,所以熔点:SiCl4<MgBr2<BN,故C错误;
D、而F的半径比N小这就使得特排的更紧密,F的电负性也大所以HF的沸点应该比NH3,而磷化氢分子间是分子间作用力,分子间作用力最小,所以沸点:PH3<NH3<HF,故D正确;
故选D.
点评 本题考查元素周期律的递变规律,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握元素的递变规律以及与对应单质、化合物的性质的关系以及比较角度.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
3.在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)?H2(g)+CO(g)△H>0 达到平衡后,只改变下列反应条件,相关叙述正确的是( )
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入CO,混合气体的密度增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入少量C,正反应速率增大 |
13.短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )
| A | B | |
| C | D | E |
| A. | 原子半径:C<D<E | |
| B. | 金属性:A>C | |
| C. | 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3 | |
| D. | 最外层电子数:A>B |
20. 将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )
将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )
①试管内黄绿色逐渐消失 ②试管内黄绿色加深
③无任何现象④试管内液面上升⑤试管内壁上有油状物生成.
 将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )
将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上(如图).现列出如下现象,其中正确的是( )①试管内黄绿色逐渐消失 ②试管内黄绿色加深
③无任何现象④试管内液面上升⑤试管内壁上有油状物生成.
| A. | ① | B. | ①④和⑤ | C. | ①和⑤ | D. | ②和⑤ |
17.关于如图所示转化关系(X代表卤素),说法不正确的是( )
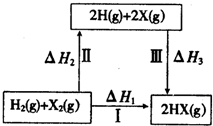

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
18.下列各醇中,能发生消去反应,且生成的烯烃只有一种的( )
| A. | CH3CH2CH(OH)CH3 | B. | CH3OH | C. | 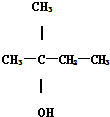 | D. |  |