题目内容
16.如表给出几种氯化物的熔、沸点:| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可气化 ④MgCl2水溶液不能导电.
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
分析 根据表格中氯化物的熔沸点判断物质的晶体类型,一般离子晶体的熔沸点大于分子晶体的熔沸点.
①根据熔沸点较高为离子晶体分析;
②根据分子晶体的熔沸点较低;
③根据物质的沸点可判断物质形成气态时的最低温度;
④根据离子晶体的水溶液中存在自由移动的电子.
解答 解:①由表格中的数据可知CaCl2的熔沸点较高,则CaCl2属于离子晶体,故①正确;
②由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,故②正确;
③由表格中的数据可知,NaCl的沸点为1465℃,则1500℃时,NaCl可形成气态分子,故③正确;
④由表格中的数据可知MgCl2的熔沸点较高,则MgCl2属于离子晶体,所以MgCl2水溶液能导电,故④错误;
故选D.
点评 本题考查晶体类型与晶体熔沸点的关系,明确表格中的数据及一般离子晶体的熔沸点大于分子晶体的熔沸点是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
1.苯酚钠水溶液中,存在的离子最多的是( )
| A. | C6H5O- | B. | Na+ | C. | H+ | D. | OH- |
4.下列关于煤、石油、天然气等资源的说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
11.有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
5.对如图所示有机物分子的叙述错误的是( )
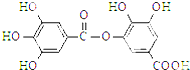

| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |

 .
.