题目内容
20.下列反应是氧化还原且不是四种基本反应类型的是( )| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
分析 属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,不属于四种反应类型,说明不具有四种反应类型特点,据此分析解答.
解答 解:A.Mn、O元素化合价发生变化,属于氧化还原反应,也属于分解反应,故A不选;
B.为复分解反应,故B不选;
C.Fe、Cu元素化合价发生变化,属于氧化还原反应和置换反应,故C不选;
D.Fe和C元素化合价发生变化,属于氧化还原反应,但不是四种基本反应类型,故D选.
故选D.
点评 本题考查了氧化还原反应及四大反应类型,明确氧化还原反应的实质及四大反应类型特点是解本题关键,根据元素化合价变化及四大反应类型特点判断即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列除杂质的方法可行的是( )
| A. | 用新制的生石灰,通过加热蒸馏,可以除去乙醇中少量的水 | |
| B. | 用酸性高锰酸钾溶液,通过洗气的方法,可以除去甲烷中的乙烯 | |
| C. | 用苯,通过分液的方法,可以除去溴苯中的溴 | |
| D. | 用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸 |
11.有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
15. 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )| A. | O+O3═2O2是吸热反应 | B. | O+O3═2O2是放热反应 | ||
| C. | 反应O+O3═2O2的△H=E3-E2 | D. | 反应O+O3═2O2的△H=E3-E1 |
5.对如图所示有机物分子的叙述错误的是( )
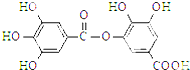

| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
12.32g SO2 所含的硫原子的物质的量为( )
| A. | 0.2 mol | B. | 0.3 mol | C. | 0.4 mol | D. | 0.5 mol |
10.根据反应式:2Fe3++2I-═2Fe2++I2,Br2+2Fe2+═2Br-+2Fe3+,可以判断微粒的氧化性从强到弱的顺序是( )
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
 .
.
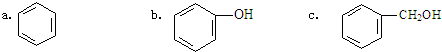
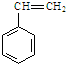 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.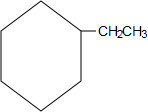 .
.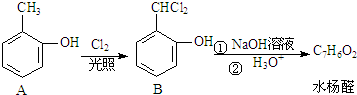
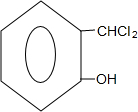 +2NaOH$→_{酸化}^{H_{2}O}$
+2NaOH$→_{酸化}^{H_{2}O}$ +2NaCl+H2O.
+2NaCl+H2O.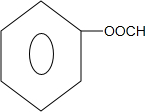 、
、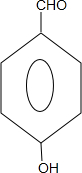 .
.