题目内容
14.18.4g某有机物和标准状况下a L O2,在密闭容器中完全燃烧后,产物为CO2、CO和H2O,将产物依次通过装有足量的①浓硫酸②灼热氧化铜③碱石灰的三个装置,①增重14.4g;②减重6.4g;③增重26.4g,若等量该有机物与钠恰好完全反应需要钠13.8g,请通过计算分析回答:(提示:一个碳上连接两个或多个羟基是不稳定的)(1)有机物的结构简式;
(2)a的值是多少?
分析 (1)燃烧后的产物为CO2、CO和H2O(g),浓硫酸增重为水的质量,通过灼热氧化铜,由于发生反应:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,导致固体的质量减轻,结合方程式利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了26.4g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据n=$\frac{m}{M}$计算水、CO、二氧化碳的物质的量,根据原子守恒计算18.4g有机物中C、H原子物质的量,再计算18.4g有机物中氧原子物质的量,确定有机物的最简式,进而确定分子式;
能与Na反应说明有机物至少含有-OH、-COOH中的一种,根据有机物与Na的物质的量之比,确定含有的官能团,进而书写有机物的结构简式;
(2)根据氧原子守恒计算氧气物质的量,根据V=nVm计算氧气体积.
解答 解:(1)令有机物燃烧生成的CO为x,一氧化碳还原氧化铜得到的二氧化碳质量是y,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,固体质量减少△m
28g 44g 16g
x y 6.4g
则$\frac{28g}{x}=\frac{44g}{y}=\frac{16g}{6.4g}$,解得x=11.2g,y=17.6g
n(CO)=$\frac{11.2g}{28g/mol}$=0.4mol,则有机物燃烧生成的CO2的质量为26.4g-17.6g=8.8g,物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,故18.4g有机物分子中n(C)=0.4mol+0.2mol=0.6mol,
有机物燃烧生成水的物质的量为$\frac{14.4g}{18g/mol}$=0.8mol,故18.4g有机物中n(H)=1.6mol,
则18.4g有机物中m(O)=18.4g-0.6mol×12g/mol-1.6mol×1g/mol=9.6g,故n(O)=0.6mol,
则有机物中N(C):N(H):N(O)=0.6:1.6:0.6=3:8:3,即最简式为C3H8O3,H原子已经饱和C原子的四价结构,故有机物的分子式为C3H8O3,
18.4gC3H8O3的物质的量为$\frac{18.4g}{92g/mol}$=0.2mol,与钠恰好完全反应需要钠13.8g,钠的物质的量为$\frac{13.8g}{23g/mol}$=0.6mol,二者按物质的量1:3反应,故该有机物含有3个-OH,故其结构简式为: ,
,
答:有机物的结构简式为 ;
;
(2)根据氧原子守恒,可知氧气的物质的量为:$\frac{0.4mol+0.2mol×2+0.8mol-0.6mol}{2}$=0.5mol,故氧气的体积为0.5mol×22.4L/mol=11.2L,
答:a的值为11.2.
点评 本题考查有机物分子式确定的有关计算、有机物结构式的确定等,关键是利用守恒法确定有机物的最简式,注意最简式中H原子饱和C的四价结构,则最简式即为分子式,难度中等.

| A. | 乙烯和 2-甲基-2-戊烯无论以什么比例混合,只要总质量一定,完全燃烧后生成 CO2的质量就一定 | |
| B. | 乙烯和环丁烷(C4H8)分子间相差两个CH2原子团,故它们互为同系物 | |
| C. | 1 mol 乙烯与 Cl2完全加成后再与 Cl2发生最大程度的取代,两个过程共需 Cl26mol | |
| D. | 以乙烯为原料制备的聚乙烯可以使酸性高锰酸钾溶液褪色 |
| A. | 用新制的生石灰,通过加热蒸馏,可以除去乙醇中少量的水 | |
| B. | 用酸性高锰酸钾溶液,通过洗气的方法,可以除去甲烷中的乙烯 | |
| C. | 用苯,通过分液的方法,可以除去溴苯中的溴 | |
| D. | 用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸 |
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
 .
.
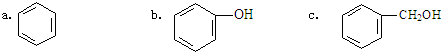
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料. .
.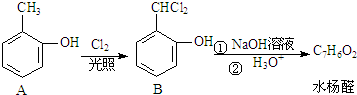
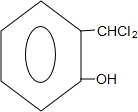 +2NaOH$→_{酸化}^{H_{2}O}$
+2NaOH$→_{酸化}^{H_{2}O}$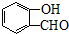 +2NaCl+H2O.
+2NaCl+H2O.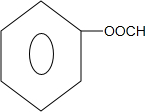 、
、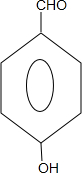 .
.