题目内容
18. 在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A. | 当v(H2)=3v(N2)时.可以说明三个容器中的反应达平衡状态 | |
| B. | 在t min时,一定达化学平衡状态的是III | |
| C. | 在t min时测得Ⅲ中c(N2)=1mol•L-1,若再向Ⅲ中充人1.5molN2和1molNH3,H2的转化率增大 | |
| D. | 三个容器中的反应均达到平衡后.氨气的质量分数Ⅰ>Ⅱ>Ⅲ |
分析 A、没有指明H2和N2的正逆反应速率;
B、根据温度越高反应速率越快,相同时间内氮气的含量越低,tmin时,氮气的含量Ⅲ比Ⅱ高,故Ⅲ到达平衡;
C、在一定温度和有催化剂存在的条件下,将1molN2和2.5molH2放入500mL密闭容器中,Ⅲ达到平衡,平衡后N2的浓度为1mol/L,利用三段式法计算平衡常数,结合浓度商和平衡常数比较分析判断平衡移动方向解决;
D、根据反应为放热反应,所以升温平衡向逆反应方向移动.
解答 解:A、若为一个表示正反应速率、另一个表示逆反应速率,反应到达平衡,若为同方向速率,选项A中关系式在任何情况下都成立,不能说明到达平衡,没有指明H2和N2的正逆反应速率,不能说明反应达到了平衡状态,故A错误;
B、由于不能确定容器II中氮气是否达到最小值,因此不能确定II是否达到平衡状态,若未达平衡,温度越高反应速率越快,相同时间内氮气的含量越低,tmin时,氮气的含量Ⅲ比Ⅱ高,故Ⅲ到达平衡,故B正确;
C、在一定温度和有催化剂存在的条件下,将1molN2和2.5molH2放入500mL密闭容器中,Ⅲ达到平衡,平衡后N2的浓度为1mol/L,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol/L):2 5 0
变化(mol/L):1 3 2
平衡(mol/L):1 2 2
K=$\frac{2{\;}^{2}}{1×2{\;}^{3}}$=0.5,保持温度不变,再向容器中同时充入1.5mol氮气和1mol氨气,则此时N2的浓度=1mol/L+$\frac{1.5mol}{0.5L}$=4mol/L,NH3的浓度=2mol/L+$\frac{1mol}{0.5L}$=4mol/L,故浓度幂Qc=$\frac{4{\;}^{2}}{4×2{\;}^{3}}$=0.5=K,则平衡不移动,H2的转化率将不变,故C错误;
D、因为该反应为放热反应,所以升温平衡向逆反应方向移动,则温度越高氨气的质量分数越小,又T1<T2<T3,所以三个容器中的反应均达到平衡后,氨气的质量分数Ⅰ>Ⅱ>Ⅲ,故D正确;
故选BD.
点评 本题考查化学平衡的移动,意在考查考生对图象的分析能力以及对化学平衡的理解,难度较大.

| A. | 碱性锌锰电池中,MnO2是催化剂 | |
| B. | 铜锌原电池工作时.Zn被氧化为Zn2+ | |
| C. | 放电时.铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 氢氧燃料电他中.通氢气的一极为正极 |
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
| A. | 零刻度 | B. | 温度 | C. | 规格(体积) | D. | 刻度线 |
 .
.
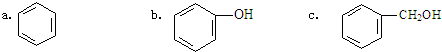
 )是一种重要的有机化工原料.
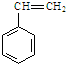
)是一种重要的有机化工原料.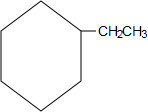 .
.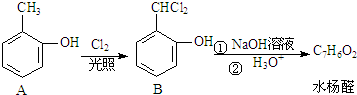
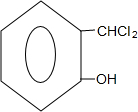 +2NaOH$→_{酸化}^{H_{2}O}$
+2NaOH$→_{酸化}^{H_{2}O}$ +2NaCl+H2O.
+2NaCl+H2O.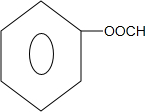 、
、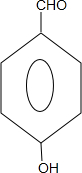 .
.
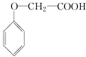 发生化学反应的产物.
发生化学反应的产物. 、
、 等.
等.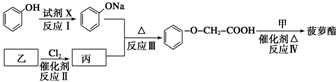
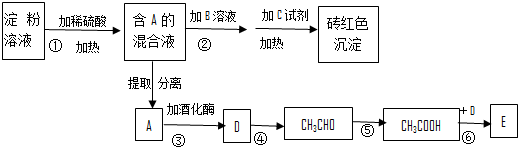
 .
.
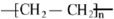 ,反应类型为加聚反应.
,反应类型为加聚反应.