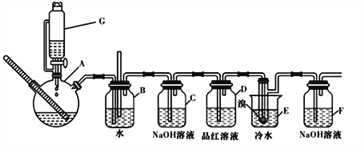
��Ŀ����
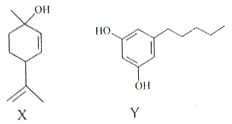
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ���ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶��С��BԪ��ԭ�ӵ��������������ڲ��������2����CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y��A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij���������ش��������⣺
��1��������X��Y��ˮ��Һ��pH��Ϊ5,������ˮ��Һ����ˮ�������H+Ũ��֮����___��
��2��A��B��D��E����Ԫ����ɵ�ij������������ֽ⡣�û�������ҺŨ��Ϊ0.1 mol/Lʱ�� pH��ӽ�_____��
A��5.6 B��7.0 C��8.4 D��13.0
��3����һ��װ�п��ƶ������ĺ��������н������·�Ӧ:C2��g��+3A2��g��![]() 2CA3��g�� ��H<0����Ӧ�ﵽƽ���������к���C2��0.5mol��A2��0.2mol��CA3��0.2 mol����ʱ���ݻ�Ϊ1.0 L��
2CA3��g�� ��H<0����Ӧ�ﵽƽ���������к���C2��0.5mol��A2��0.2mol��CA3��0.2 mol����ʱ���ݻ�Ϊ1.0 L��
�ٴ��ƽ��ǰ��������ʼ�������£����в���������_______________��
A��C2��0.6mol�� A2��0.5mol�� CA3��0mol
B��C2��0mol�� A2��0mol�� CA3��1.2mol
C��C2��0.55mol��A2��0.35mol��CA3��0.1mol
D��C2��0.8mol��A2��1.1mol��CA3��0mol
�ڴ�ƽ����ϵ��ƽ�ⳣ��K��____________________��
����������¶Ⱥ�ѹǿ���䣬������ƽ����ϵ�м���0.18molC2��ƽ�⽫_________������������������ƶ���
��4����֪���³�ѹ�£�0.5mol B2A2��������D2��Ӧ������BD2��Һ̬A2D���ų�649.8 kJ ��������д��B2A2ȼ���ȵ��Ȼ�ѧ����ʽ________________________________��
���𰸡� 10��4�U1 ����1�U104�� C B��D 10 ���� C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ��H����1299.6kJ��mol��1
��������A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С����AΪHԪ�أ�A��Eͬ���壬����ԭ������������2����EΪNa��BԪ��ԭ�ӵ��������������ڲ��������2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����BΪ̼Ԫ�أ�CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪNԪ�أ�XΪHNO3��YΪNH4NO3��A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij����������DΪOԪ�ء�
(1)������HNO3��NH4NO3��ˮ��Һ��pH��Ϊ5������ˮ��Һ����ˮ�������H+Ũ�ȵ�����Һ������������Ũ�ȣ���ˮ�����H+Ũ��Ϊ![]() mol/L=10-9mol/L�����������Һ��������Դ��ˮ�ĵ��룬������ˮ��Һ����ˮ�������H+Ũ��֮�� 10-9mol/L��10-5mol/L=10-4��1���ʴ�Ϊ��10-4��1��
mol/L=10-9mol/L�����������Һ��������Դ��ˮ�ĵ��룬������ˮ��Һ����ˮ�������H+Ũ��֮�� 10-9mol/L��10-5mol/L=10-4��1���ʴ�Ϊ��10-4��1��
(2)A��B��D��E����Ԫ����ɵ�ij��������ΪNaHCO3��Ũ��Ϊ0.1mol/Lʱ��̼�����ˮ�⣬��Һ�ʼ��ԣ���Һ������������Ũ��ԶС��0.1mol/L������ҺpH��ӽ�8.4����ѡC��
(3)��һ��װ�п��ƶ������ĺ��������н������·�Ӧ��C2(g)+3A2(g)�T2CA3(g)��H��0����Ӧ�ﵽƽ���������к���C2��0.5mol��A2��0.2mol��CA3��0.2mol�����ݻ�Ϊ1.0L����A��0.2molCA3ת��ΪC2��A2��C2��0.6mol�� A2��0.5mol��CA3 0mol��ֻҪ��Ӧ��ʼʱ������Ӧ��ʼ���ɣ��������⣬��A��ȷ��B�����ݷ���ʽ��C2��0.5mol��A2��0.2mol����ǡ����ȫת��ΪCA3�����C2��0mol�� A2��0mol�� CA3��1.2mol��ƽ����ܵõ�C2��0.5mol��A2��0.2mol��CA3��0.2mol�����������⣬��B����C��0.1molCA3ת��ΪC2��A2��C2��0.55mol��A2��0.35mol��CA3��0.1mol��ֻҪ��Ӧ����������м��ɣ��������⣬��C��ȷ��D��C2��0.6mol�� A2��0.5mol����0mol��C2��0.8mol��A2��1.1mol��CA3��0mol���ǵ�ͬƽ�⣬ƽ��ʱ���ܵõ�C2��0.5mol��A2��0.2mol��CA3��0.2mol����������������D����ѡBD��
���������Ϊ1L�������ʵ�������Ũ�ȼ���ƽ�ⳣ�����ʴ�ƽ����ϵ��ƽ�ⳣ��K=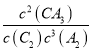 =
=![]() =10���ʴ�Ϊ��10��
=10���ʴ�Ϊ��10��
����������¶Ⱥ�ѹǿ���䣬������ƽ����ϵ�м���0.18molC2����ʱ���������Ϊ1L��![]() =1.2L����ʱŨ����Qc=
=1.2L����ʱŨ����Qc=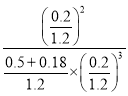 =10.6��K=10����ƽ�⽫�����ƶ����ʴ�Ϊ������
=10.6��K=10����ƽ�⽫�����ƶ����ʴ�Ϊ������
(4)0.5mol C2H2��������������Ӧ������CO2��Һ̬ˮ���ų�649.8 kJ����������1molҺ̬C2H2��Ӧ�ų�������Ϊ��649.8 kJ��![]() =1299.6kJ���÷�Ӧ���Ȼ�ѧ����ʽ��C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ��H����1299.6kJ��mol��1���ʴ�Ϊ��C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ��H����1299.6kJ��mol��1��
=1299.6kJ���÷�Ӧ���Ȼ�ѧ����ʽ��C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ��H����1299.6kJ��mol��1���ʴ�Ϊ��C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ��H����1299.6kJ��mol��1��

����Ŀ����CH3CH2CH2Br�Ʊ�CH3CH(OH)CH2OH�����η����ķ�Ӧ���ͺͷ�Ӧ��������ȷ����
ѡ�� | ��Ӧ���� | ��Ӧ���� |
A | �ӳɡ�ȡ������ȥ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
B | ��ȥ���ӳɡ�ȡ�� | NaOH����Һ/���ȡ����¡�KOHˮ��Һ/���� |
C | ������ȡ������ȥ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
D | ��ȥ���ӳɡ�ˮ�� | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
A. A B. B C. C D. D