题目内容
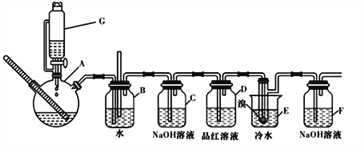
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
【答案】 (1)恒压分液漏斗; (2)防止倒吸;(3) 1,2-二溴乙烷易凝结成固体而发生堵塞;(4)副反应发生或反应太剧烈乙醇部分挥发;(5)尾气的成分是乙烯和溴,二者都易溶于四氯化碳;(6) 27.3%。
【解析】(1)G的名称为恒压分液漏斗; 故答案为:恒压分液漏斗;
(2)长直导管的作用是防止倒吸,故答案为:防止倒吸;
(3)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,由表中数据可知1,2-二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2-二溴乙烷会凝结为固体,从而导致导管堵塞;故答案为:1,2-二溴乙烷易凝结成固体而发生堵塞;
(4)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;故答案为:副反应发生或反应太剧烈乙醇部分挥发;
(5)实验中尾气的成分是乙烯和溴,二者都易溶于四氯化碳,所以能用四氯化碳液体吸收多余的气体;故答案为:尾气的成分是乙烯和溴,二者都易溶于四氯化碳;
(6)n(乙醇)=(100mL×0.79g/mL)÷46g/mol=1.7173mol,n(1,2-二溴乙烷)=(40mL×2.2g/mL)÷188g/mol=0.4681mol,该反应的产率为![]() ×100%=27.3%;故答案为:27.3%。
×100%=27.3%;故答案为:27.3%。

【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。