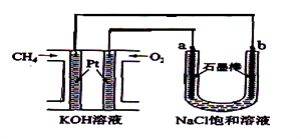
题目内容
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

【答案】 1 1s22s22p63s23p63d9或[Ar]3d9 sp3杂化 平面正三角形 氨分子与水分子间形成氢键 b 一水合氨电离产生铵根离子和氢氧根离子 深蓝色 Cu2++4NH3·H2O=[Cu(NH3)4] 2++4H2O 4 389/(NA·a3×10-21)
【解析】根据表中五种元素的相关叙述,可知这五种元素分别是H、F、N、S、Cu。所以分析如下(1)铜的基态电子排布式为1s22s22p63s23p63d104s1,所以有1个未成对电子;则Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;
(2)在H2S分子中,S原子的杂化类型为sp3;SO3分子为非极性分子,形成两个S=O和一个配位键,所以其空间构型为平面正三角形;
(3)NH3极易溶于水,主要原因是氨分子和水分子间能够形成氢键;由于N元素的电负性大于O元素,所以NH3分子中的N元素更容易与H2O分子中H元素结合成键,因此NH3·H2O的合理结构为b,也可从NH3·H2O![]() NH4++ OH—说明NH3·H2O的合理结构为b;
NH4++ OH—说明NH3·H2O的合理结构为b;
(4)CuSO4溶液中滴入过量氨水,形成[Cu(NH3)4]2+使溶液呈深蓝色,反应的离子方程式为Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O;
(5)由ZnS的晶胞结构分析可知,每个S2—周围等距最近的Zn2+有4个,即其配位为4;
(6)由图2分析可知,该晶胞中的Cu原子数=![]() =3,Au原子数为
=3,Au原子数为![]() =1,所以其化学式为AuCu3,则该晶胞的质量为m=
=1,所以其化学式为AuCu3,则该晶胞的质量为m=![]() g,其体积为V=a3×10-21 cm3,所以其密度为
g,其体积为V=a3×10-21 cm3,所以其密度为![]() g/cm3。
g/cm3。

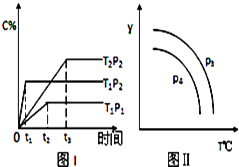
【题目】(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的是___________。
A.①>②>③ B.③>①>② C.②>③>① D.③>②>①
(3)比较填空(选填“>"或“ <"或"=”)
①常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a____b。
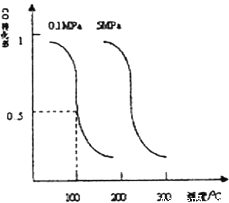
②已知某可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b____c+d。
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b____c+d。

(4)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) ![]() CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________。
②反应为___________反应(填“吸热”或“放热”)。
③800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正_______v逆(填“>"或“<”或“=”)