题目内容
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: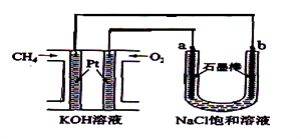
(1)甲烷燃料电池负极的电极反应为:。
(2)b电极上得到的气体是 , 电解氯化钠溶液的总反应方程式为 。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极。
【答案】
(1)CH4-8e-+10OH-=CO32-+7H2O
(2)H2,2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)4L
(4)CH3OH+8OH--6e-=CO32-+6H2O
【解析】(1).甲烷在碱性条件下失去电子生成碳酸根离子和水,电极反应为: CH4-8e-+10OH-=CO32-+7H2O;
(2). B极连接甲烷,则为阴极,溶液中的氢离子放电生成氢气,电解氯化钠溶液生成氢氧化钠和氢气和氯气,所以答案是:H2;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3). 通入1L甲烷,其物质的量为1/22.4mol,则失去的电子数为8/22.4mol,根据电荷守恒分析,最多产生的氯气为4/22.4mol,则标况下的体积为4L;
(4).甲醇在碱性条件下失去电子结合氢氧根离子,生成碳酸根离子和水,电极反应为: CH3OH+8OH--6e-=CO32-+6H2O。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。