题目内容
【题目】【加试题】I.无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42g离子化合物D,D的水溶液的pH<7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
Ⅱ.雾霾已经成为社会各界共同关注的热门话题,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①该反应在低温下能自发进行,该反应的△H 0。(选填“>”、“<”)
②在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如右图所示(已知:t2-tl = t3-t2)。则下列说法不正确的是 。(填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
C(s)+H2O(g)![]() CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
H2O(g)+CO(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3

①△H3和△H1、△H2的关系为△H3= 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在右图中画出tl时刻后H2的体积分数变化趋势曲线。(t2时刻重新达到平衡)
【答案】I.(1)N4S4 ![]()
(2)6SCl2+16NH3=N4S4+2S+12NH4Cl
Ⅱ.(1)①< ② D
(2)①△H1+△H2 ②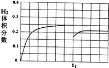
【解析】
试题分析:I.隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色,该淡黄色物质在空气中加热会燃烧并产生刺激性气味,则B为S;在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D,气体C在标准状况下的密度为0.76gL-1,C相对分子质量=0.76×22.4=17,可推知C为NH3,加热D发现无任何物质存在,D的水溶液的pH小于7,可推知D为NH4Cl,2.72g氨气中N原子物质的量=![]() =0.16mol,6.42g氯化铵中N原子物质的量=
=0.16mol,6.42g氯化铵中N原子物质的量=![]() =0.12mol<0.16mol,由元素守恒可知A中含有S、N元素,经测定A(相对分子质量为184)含两种元素,原子个数比为1:1,令A的分子式为(SN)x,则46x=184,解得x=4,故A分子式为N4S4;
=0.12mol<0.16mol,由元素守恒可知A中含有S、N元素,经测定A(相对分子质量为184)含两种元素,原子个数比为1:1,令A的分子式为(SN)x,则46x=184,解得x=4,故A分子式为N4S4;
(1)由上述分析可知,A的化学式为N4S4,C为NH3,其电子式为:![]() ;
;
(2)SCl2和气体NH3反应的化学方程式为:6SCl2+16NH3=N4S4+2S+12NH4Cl;
Ⅱ.(1)①由热化学反应方程式可知,该反应为熵减小过程,即△S>0,要使反应在低温下能够自发进行,必须满足△G=△H-T△S<0,可知反应放热△H<0;
②A.根据图象可知c点反应速率还再变化,因此不是平衡状态,故A正确;B.反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,开始阶段反应速率逐渐增大,反应速率a点小于b点,故B正确;C.随着反应的进行,反应物的浓度逐渐减小,所以a点反应物的浓度大于b点,故C正确;D.根据曲线的斜率:tl~t2段<t2~t3段,可知t2~t3段反应速率快,反应物的转化率大,故D错误;故答案为D;
(2)下列反应:
C(s)+H2O(g)CO(g)+h2(g)△H1
H2O(g)+CO(g)CO2(g)+H2(g)△H2
C(s)+2H2O(g)CO2(g)+2H2(g)△H3
①根据盖斯定律可知△H3=△H1+△H2;
②H2O(g)+CO(g)CO2(g)+H2(g)
起始量 1 1 0 0
转化量 0.5 0.5 0.5 0.5
平衡量 0.5 0.5 0.5 0.5
平衡常数k=1;
有50%的CO转化为CO2;则n(H2)=n(CO)转化=0.5mol,刚充入1mol H2O时氢气的体积分数为![]() =
=![]() ;
;
但是平衡向右移动,设达新平衡时氢气的物质的量为x,
H2O(g)+CO(g)CO2(g)+H2(g)
2 1 0 0
x x x x
2-x 1-x x x
k=![]() =1 x=
=1 x=![]() 新平衡时氢气的体积分数为
新平衡时氢气的体积分数为![]() =
=![]() ;
;
故图象的起点为![]() ,终点为
,终点为![]() ;tl时刻后H2的体积分数变化趋势曲线为
;tl时刻后H2的体积分数变化趋势曲线为
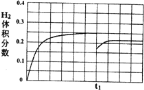 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案