��Ŀ����
����Ŀ������ѧ����ѡ��5���л���ѧ������
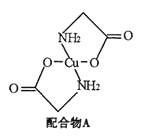
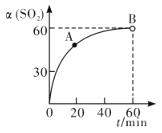
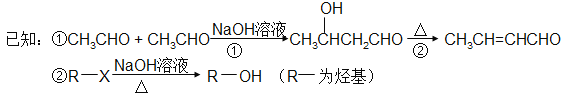
�л���A��C11H12O5��ͬʱ���������������ٺ������Ҳ��������ڱ�����һ��ȡ����ֻ��2�֣���1 mol A��������NaHCO3��Ӧ����1 mol CO2������FeCl3��Һ����ɫ��A����ͼ��ʾת����ϵ��

��֪��
�ش��������⣺
��1��A���� �ֹ����ţ�H�ķ���ʽΪ ��
��2����C����G�ķ�Ӧ������ ��
��3��G�Ľṹ��ʽΪ ��K�Ľṹ��ʽΪ ��
��4����д��C��D��Ӧ�Ļ�ѧ����ʽ ��
��д��I��J��Ӧ�����ӷ���ʽ ��
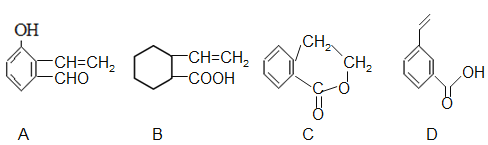
��5����C��ͬ���칹������ͬʱ��������������a���ܷ���������Ӧ��b���ܷ���������Ӧ��c������Na��Ӧ����H2�������� �֣����������칹�������к˴Ź���������ʾΪ3��壬�ҷ������Ϊ6�s1�s1���� ��д�ṹ��ʽ)��
��C������ͬ���칹��������һ�ֱ�����������ʾ���źţ������ݣ���ȫ��ͬ����������___________(����)��
A��Ԫ�ط����� B�������� C����������� D���˴Ź�����
���𰸡�˵�����ṹ��ʽ�ж��������̼�����ļ���Ӧ�Ŀ���0�֡�
��1��3��C7H4O3Na2
��2��������Ӧ����ȥ��Ӧ
��3��

��4����![]()
��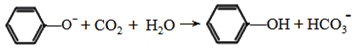
��5��5��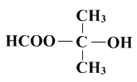 �� A
�� A
��������
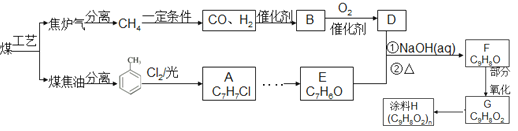
�����������F�Ľṹ������ת����ϵ����EΪCH2=CHCH2COOH��C��Ũ������ȵ������·�����ȥ��Ӧ����CH2=CHCH2COOH��C��A����ˮ�����ɵ�B�ữ������A�в���������CΪHOCH2CH2CH2COOH��BΪHOCH2CH2CH2COONa��C�ڴ��������·������۷�Ӧ���ɾ���D��D�Ľṹ��ʽΪ![]() ��C��Ũ������ȵ������·���������������Ӧ������Ԫ����G��G�ĽṹΪ
��C��Ũ������ȵ������·���������������Ӧ������Ԫ����G��G�ĽṹΪ![]() ���л���A�ķ���ʽΪC11H12O5��ͬʱ���������������ٺ������Ҳ��������ڱ�����һ��ȡ����ֻ��2������������ȡ������λ�ڶ�λ����1 mol A��������NaHCO3��Ӧ����1 mol CO2��A�к���1���Ȼ�������FeCl3��Һ����ɫ���������ǻ�������ˮ������B���ṹ��ʽΪHOCH2CH2CH2COONa����H����A�Ľṹ��ʽΪ
���л���A�ķ���ʽΪC11H12O5��ͬʱ���������������ٺ������Ҳ��������ڱ�����һ��ȡ����ֻ��2������������ȡ������λ�ڶ�λ����1 mol A��������NaHCO3��Ӧ����1 mol CO2��A�к���1���Ȼ�������FeCl3��Һ����ɫ���������ǻ�������ˮ������B���ṹ��ʽΪHOCH2CH2CH2COONa����H����A�Ľṹ��ʽΪ![]() ��HΪ
��HΪ![]() ����������Ϣ�ƶ�IΪ
����������Ϣ�ƶ�IΪ![]() ��JΪ
��JΪ![]() ��KΪ
��KΪ ���ݴ�����
���ݴ�����
��1��A�Ľṹ��ʽΪ![]() �����������ǻ����������Ȼ�3�ֹ����ţ�HΪ
�����������ǻ����������Ȼ�3�ֹ����ţ�HΪ![]() ������ʽΪC7H4O3Na2��
������ʽΪC7H4O3Na2��
��2��C��Ũ������ȵ������·���������������Ӧ������Ԫ����G����Ӧ������������Ӧ��ȡ����Ӧ��
��3��G�Ľṹ��ʽΪ![]() ��K�Ľṹ��ʽΪ
��K�Ľṹ��ʽΪ ��
��
��4����C�ڴ��������·������۷�Ӧ���ɾ���D����ѧ����ʽΪ
![]() ��
��
��I��J��Ӧ�����ӷ���ʽΪ![]() ��
��
��5����CΪHOCH2CH2CH2COOH����ͬ���칹������ͬʱ��������������a���ܷ���������Ӧ�������Ȼ���b���ܷ���ˮ����Ӧ��Ϊ����������c������Na��Ӧ����H2�������ǻ�����HCOOCH2CH2CH2OH��HCOOCH2CH��OH��CH3��HCOOCH��OH��CH2CH3��HCOOCH��CH3��CH2OH��HCOOC��OH����CH3��2����5�֡����к˴Ź���������ʾΪ3��壬�ҷ������Ϊ6�s1�s1����HCOOC��OH����CH3��2����C������ͬ���칹��Ԫ����ɡ���������ͬ����Ԫ�ط�������ʾ���źţ������ݣ���ȫ��ͬ��ѡA��

����Ŀ���������⡿�����������н�����ʹ���ã��ǽ���ʹ�õĽ�����ʹҩ���С����ȱ���֮�ƣ����Ʊ�ԭ�����£�
��֪��![]()
�������ױ�������
�����������������ʹ���IJ��������������±���
���� | �۵�/�� | �е�/�� | �ܽ��� |
�������� | 114.3 | 305 | ������ˮ����������ˮ |
���� | ��6 | 184.4 | ����ˮ |
���� | 16.6 | 118 | ������ˮ |
ʵ�鲽�����£�
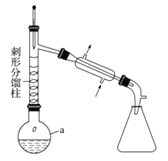
����1����a�У�����9mL (0.10 mol)������15 mL(0.27 mol)�����ἰ����п�ۣ�������ͼװ����װ������
����2�������¶ȼƶ�����105�����ң�С����Ȼ�������Ӧ��ȫ��
����3�����Ƚ���Ӧ����ﵹ��ʢ��100 mL ��ˮ���ձ��У���ȴ����ˡ�ϴ�ӣ��õ��ֲ�Ʒ��
����4��������3���ôֲ�Ʒ��һ���ᴿ�Ƶò�Ʒ����Ϊ10.8g��
��ش��������⣺
��1������a������Ϊ ����ѡ����a����ѹ���� (�����)��
A�� 25 mL B��50 mL C��100 mL D��250 mL
��2��ʵ���м�������п�۵�Ŀ���� ��
��3������2�У������¶ȼƶ�����105�����ҵ�ԭ���� ��
��4���жϷ�Ӧ�ѻ�����ȫ�ķ���Ϊ ��
��5������3�г��Ƚ�����ﵹ��ʢ����ˮ���ձ��У������ȡ���ԭ���� ��
��6������4�дֲ�Ʒ��һ���ᴿ�����ᴿ������ ��
��7������ʵ��IJ���Ϊ ��