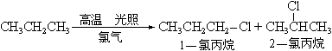题目内容
【题目】【化学——物质结构与性质】
氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________________________
(3)N2F2分子中N原子的杂化方式是___________________,l mol N2F2含有______mol![]() 键。
键。
(4)NF3的键角______NH3的键角(填“<”“>”或“=”),原因是__________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4_________mol配位键。
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑

①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子____________。
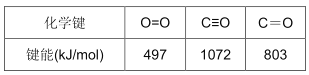
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为_____,Na2O晶体的密度为_____g·cm-3(只要求列算式,不必计算出结果)
【答案】(1)洪特规则 3d54s1
(2)NOC或N>O>C
(3)sp2 3
(4)<F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围电子密度
(5)2
(6)①N2O、CO2、CNS—、NO2+等 ②8 ![]() 或
或![]()
【解析】
试题分析:(1)基态N原子的核外电子排布式为1s22s22p3,对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同,故电子在2p轨道上的排布遵循的原则是洪特规则。前4周期元素中,基态原子核外电子排布成单电子数最多为铬元素,有6个未成对电子,价层电子排布式为3d54s1。
(2)同周期由左向右元素原子的第一电离能呈递增趋势,但氧原子价电子排布式为2s22p4,氮原子价电子排布式为2s22p3,处于半充满状态,较稳定,故C、N、O三种元素第一电离能从大到小的顺序是N>O>C。
(3)N2F2分子结构式为F﹣N=N﹣F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键。
(4)F元素电负性比H大,F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,成键电子对之间的排斥力较小,因而NF3的键角<NH3的键角。
(5)NH4BF4 中铵根离子中含有1个配位键,B原子与F之间形成1个配位键,l mol NH4BF4含有2mol配位键。
(6)①与N3﹣互为等电子体的分子或离子为CO2、CNO﹣等。②晶胞中白色球数目为8×1/8+6×1/2=4、黑色球数目为8,Na原子与氧原子数目之比为2:1,则白色球为氧原子、黑色球为Na原子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4mol× 62g/mol=4×62g,则晶胞密度为4×62 /(566×10﹣10 )3NA gcm﹣3。

 名校课堂系列答案
名校课堂系列答案【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
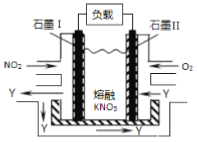
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
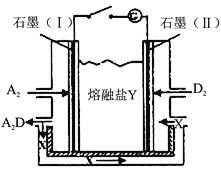
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
【题目】【加试题】乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
已知:![]()
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
实验步骤如下:
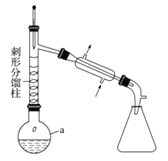
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为 ,所选仪器a的最佳规格是 (填序号)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)实验中加入少许锌粉的目的是 。
(3)步骤2中,控制温度计读数在105℃左右的原因是 。
(4)判断反应已基本完全的方法为 。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是 。
(6)步骤4中粗产品进一步提纯,该提纯方法是 。
(7)本次实验的产率为 。