题目内容
8.氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空: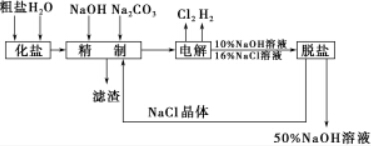
(1)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓.
(2)如果粗盐中SO$\stackrel{2-}{4}$含量较高,必须添加钡试剂除去,该钡试剂可以是ac(选填a、b、c). a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为了有效地除去Ca2+、Mg2+、SO$\stackrel{2-}{4}$,加入试剂的合理顺序为bc(选填a、b、c).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过加热蒸发、冷却、过滤(填写操作名称)除去NaCl.
(5)在电解过程中,与电源负极相连的电极上的电极反应式为2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),
若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是淀粉、碘化钾(或淀粉碘化钾溶液).
分析 (1)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(4)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法;
(5)电解池的阴极上是氢离子得电子的还原反应,阳极上是氯离子失电子的氧化反应,产生的氯气能使湿润的淀粉碘化钾试纸变蓝.
解答 解:(1)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用,
故答案为:ac;
(3)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应BaCl2溶液再Na2CO3溶液之前加即可,所以加入试剂顺序为bc,故答案为:bc;
(4)根据表中数据可以得出:氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发结晶,趁热过滤;故答案为:蒸发结晶,过滤;
(5)电解氯化钠溶液,根据放电顺序,电解池的阴极上是氢离子得电子的还原反应,2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),阳极上是氯离子失电子的氧化反应,产生的氯气能使湿润的淀粉碘化钾试纸变蓝检验试剂是:淀粉、碘化钾(或淀粉碘化钾溶液).
故答案为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-);淀粉、碘化钾(或淀粉碘化钾溶液).
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.05 mol | B. | 1 mol | C. | 0.1 mol | D. | 0.2 mol |
| A. | 1:2:3 | B. | 1:3:3 | C. | 1:6:9 | D. | 1:3:6 |
| A. | $\frac{1}{{K}_{2}}$,2a | B. | $\frac{1}{K}$,a | C. | K2,a | D. | K,2a |
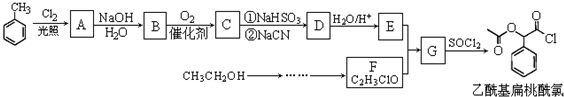

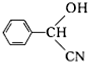 .
.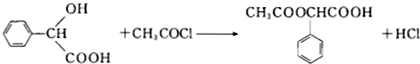 .
. .
.