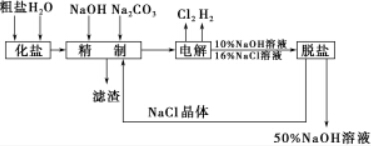
题目内容
18.完成以下化学方程式(1)3S+6KOH═2K2S+1K2SO3+3H2O
(2)2 KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O.
分析 (1)反应中硫元素从硫单质中的0价部分升高到亚硫酸钾中的+4价,部分降为硫化钾中的-2价,依据氧化还原反应得失电子守恒规律,硫化钾系数为2,亚硫酸钾系数为1,结合原子个数守恒配平方程式;
(2)反应中锰元素从高锰酸钾中+7价降为溴化锰中的+2价,部分-1价溴离子升高到溴单质中0价,依据氧化还原反应得失电子守恒规律,高锰酸钾系数为2,溴单质系数为5,结合原子个数守恒配平方程式.
解答 解:(1)反应中硫元素从硫单质中的0价部分升高到亚硫酸钾中的+4价,部分降为硫化钾中的-2价,依据氧化还原反应得失电子守恒规律,硫化钾系数为2,亚硫酸钾系数为1,依据原子个数守恒,硫单质系数为3,氢氧化钾系数为6,水系数为3,方程式为::3S+6KOH=2K2S+K2SO3+3H2O;
故答案为:3;6;2;1;3;
,2)反应中锰元素从高锰酸钾中+7价降为溴化锰中的+2价,部分-1价溴离子升高到溴单质中0价,依据氧化还原反应得失电子守恒规律,高锰酸钾系数为2,溴单质系数为5,依据原子个数守恒,该反应方程式:
2KMnO4+16HBr(浓)═2KBr+2MnBr2+8H2O+5Br2↑,
故答案为:2;16;5;2;2;8.
点评 本题考查了氧化还原方程式配平,准确判断元素化合价变化,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
17.某粗碘样品中含有氯化碘(ICl)和溴化碘(IBr),它们的性质和卤素单质相似,利用碘的升华提纯碘之前,要加适量的某物质对粗碘进行预处理,加入的物质可能是( )
| A. | 碘化钾 | B. | 硝酸银 | C. | 溴化钠 | D. | 液氯 |
9.一定温度下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),反应过程中测得的有关数据见下表:
下列说法不正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
10.下列有关实验的叙述正确的是( )
| A. | 实验室中用生石灰与浓氨水混合的方法不能制得氨气 | |
| B. | 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
7.室温下,对pH相等、体积相同的盐酸和醋酸分别进行以下操作,下列说法正确的是( )
| A. | 将温度迅速升高20℃,两溶液的pH均增大 | |
| B. | 加水稀释相同倍数后,两溶液的pH同等程度减小 | |
| C. | 加少量的醋酸钠固体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,两溶液产生的氢气的量一样多 |
 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是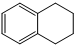 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: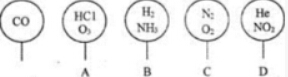 取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )
取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )