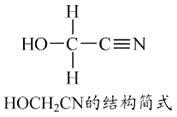
题目内容
【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 完全反应后混合溶液的最高温度 偏小 1.31 kJ 偏大 NH3.H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等)
【解析】
(1)在该实验中,为使盐酸与NaOH溶液充分混合,需要搅拌, 故图中缺少的玻璃仪器是环形玻璃搅拌棒;
(2)中和热测定实验中,关键是减少热量损失,所以装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,
(4) 大烧杯上如不盖硬纸板,则会造成热量损失,导致测定温度差偏小,最终求得的中和热数值偏小;
(5)第三次得到温度差误差较大,应该舍弃,所以平均温度差为(3.25+3.0)℃/2=3.125℃,溶液的质量为100mL×1g/Ml=100g,所以反应中放出的热量是4.18J/(g·℃ ) ×100g ×3.125℃=1306.25J=1.31 kJ;
(6)一水合氨为弱碱,电离过程为吸热过程,放出的热量偏少,但酸碱中和为放热反应,所以用50 mL0.55mol/L的氨水代替NaOH溶液进行上述实验,测得的中和热△H会偏大;

【题目】除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) ![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为________;
② 下列能增大碳的转化率的措施是________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。
(3)合成气合成甲醇的主要反应是:2H2(g)+CO(g) ![]() CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。
② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是____________。
(5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。
【题目】已知,25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2C2O4 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=5.9×10-2,K2=6.4×10-6 |
下列有关说法正确的是( )
A. CH3COOH溶液与Na2CO3反应生成CO2可以证明乙酸是弱酸
B. H2C2O4溶液的电离方程式为 H2C2O4![]() 2H+ + C2O42-
2H+ + C2O42-
C. 加水稀释HCN溶液,促进HCN的电离且c(CN-)/c(OH-)增大
D. 在Na2C2O4 溶液中加入足量的CH3COOH溶液发生反应的离子方程式为 C2O42- + CH3COOH=CH3COO- + HC2O4-