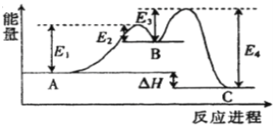
题目内容
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
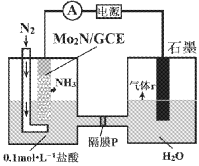
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快酸溶速率;避免制备MgCO3时消耗更多的碱
(2)H2O2+2Fe2++2+=2Fe3++2H2O (3)①分液漏斗;②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向
上层清液中滴加Na2CO3溶液,若无沉淀生成,
【解析】
试题(1)加热可以加快化学反应速率;如果硫酸过多,则需要消耗更多的减中和硫酸,从而造成生产成本增加。(或影响Mg2+转化成MgCO3。)
(2)滤液中含有Fe2+,加入H2O2将Fe2+氧化为Fe3+,发生发应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①根据仪器A的构造确定其名称为分液漏斗。②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,充分振荡、静置、分液,并重复多次。
(4)根据题给信息知向溶液中加入氨水调节pH不大于8.5,不小于5.0,故由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。

【题目】氨基甲酸铵(H2 NCOONH4)是一种易分解、易水解的白色固体。其研究小组以浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图1所示,其主要反应的原理为2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0
NH2COONH4(s) △H<0


(1)仪器1的名称是___________。仪器3中盛装的固体是___________,其作用是___________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该___________(填“加快”“减慢”或“不改变”)产生氨气的速率。
(3)另一种制备氨基甲酸铵的反应装置(液体石蜡和CCl4均充当惰性介质)如图2所示。
①液体石蜡鼓泡瓶的作用是______________________。
②若无冰水,则氨基甲酸铵易分解生成尿素[CO(NH2)2]请写出氨基甲酸铵受热分解的化学方程式:______________________。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是___________(填标号)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入___________ | ___________,则证明固体中含有碳酸氢铵 |
②根据①的结论。取15.8g氨基甲酸铵样品,用足量氧氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为___________。
【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。