题目内容
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
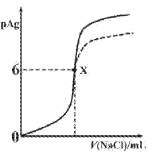
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
【答案】B
【解析】
A.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=1mol/L,即原AgNO3溶液的物质的量浓度为1mol·L-1,故A错误;
B.x点c(Ag+)=1![]() mol·L-1,一般认为溶液中离子浓度小于
mol·L-1,一般认为溶液中离子浓度小于![]() mol·L-1完全沉淀,故B正确;
mol·L-1完全沉淀,故B正确;
C.x点c(Ag+)=1![]() mol·L-1,,一般认为溶液中离子浓度小于
mol·L-1,,一般认为溶液中离子浓度小于![]() mol·L-1,即沉淀完全,则AgNO3与NaCl恰好反应,由A求得原AgNO3溶液的物质的量浓度为1mol·L-1,则有:n(NaCl)=n(AgNO3)=0.01L
mol·L-1,即沉淀完全,则AgNO3与NaCl恰好反应,由A求得原AgNO3溶液的物质的量浓度为1mol·L-1,则有:n(NaCl)=n(AgNO3)=0.01L![]() 1mol/L=0.01mol,所以v(NaCl)=100ml,即x点的坐标为(100,6),故C错误;
1mol/L=0.01mol,所以v(NaCl)=100ml,即x点的坐标为(100,6),故C错误;
D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把NaCl换成0.1mo1·L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
本题答案为B。

【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。
【题目】氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意图如下图。则N-H键键能为( )

化学键 | H-H | N≡N |
键能(kJ/mol) | 436 | 946 |
A. 248kJ/mol B. 391kJ/mol C. 862kJ/mol D. 431kJ/mol