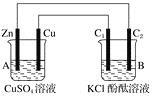
题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=___________kJ/mol(用含a、b的代数式表示)
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:

(1)①T℃时,在容器中若充入稀有气体,平衡___________移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡___________移动。
②CO体积分数为80%时,CO2的转化率为___________。
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=___________(用含p总的代数式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:

则△H___________0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
【答案】![]() 正向 不 67% 0.5p总 > p1>p2>p3
正向 不 67% 0.5p总 > p1>p2>p3
【解析】
Ⅰ.根据盖斯定律△H3=(2△H1+△H2)/3;
Ⅱ. (1)①该反应正向气体分子数增大,恒温恒压时充入稀有气体相当于减压,平衡正向移动;T℃反应达到平衡时CO2、CO的体积分数相同,即浓度相等,恒压时充入等体积的CO2、CO,平衡不移动;
②列三行式计算平衡常数;
③类比K计算Kp;
(2)温度升高,乙苯的平衡转化率增大,平衡正向移动,正反应为吸热反应;压强增大,乙苯的平衡转化率减小,则p1>p2>p3。
Ⅰ. ①Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
②3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
由盖斯定律[①×2+②]![]() 3得到Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g) △H3=
3得到Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g) △H3=![]() kJ/mol,
kJ/mol,
故答案为:![]() ;
;
Ⅱ. (1)①该反应正向气体分子数增大,恒温恒压时充入稀有气体相当于减压,平衡正向移动;由图像可知,T℃反应达到平衡时CO2、CO的体积分数相同(均为50%),即浓度相等,恒压时充入等体积的CO2、CO,平衡不移动;
故答案为:正向;不;
②设CO2的转化率为α,由已知列三段式得:
化学反应方程式:C(s)+CO2(g) ![]() 2CO(g)
2CO(g)
起始量(mol) 1 0
转化量(mol) α 2α
平衡量(mol) 1-α 2α
根据题意列关系式:![]() ×100%=80%,解得:α=67%;
×100%=80%,解得:α=67%;
故答案为:67%;
③用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=![]() ,由图可得,T ℃时 CO 体积分数为 50%,分压为 50%×p总,CO2 体积分数为 1-50%=50%,分压为50%×p总,所以
,由图可得,T ℃时 CO 体积分数为 50%,分压为 50%×p总,CO2 体积分数为 1-50%=50%,分压为50%×p总,所以![]() =
=![]() =0.5p总;
=0.5p总;
故答案为:0.5p总;
(2)温度升高,乙苯的平衡转化率增大,平衡正向移动,正反应为吸热反应,该反应的△H >0;该反应的△n(气)>0,压强增大,乙苯的平衡转化率减小,则p1>p2>p3。
故答案为:>;p1>p2>p3。