题目内容
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):

分析图象,回答下列问题:
(1)在图象反应Ⅰ中,此正反应为________(填“吸热”或“放热”)反应,若p1>p2,则此反应的△S________0(填“>”或“<”),由此判断,此逆反应自发进行,必须满足的条件是____________.
(2)在图象反应Ⅱ中,T1_____T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T1<T2,则该反应_______(填“能”或“不能”)自发进行.
【答案】 放热 < 高温 > 放热 不能
【解析】(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0.放热、熵减反应只能在低温下自发进行,如逆反应自发进行,应在高温下;
(2)反应Ⅱ中先拐先平温度高,T1温度下反应先达到平衡状态,说明T1>T2;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1<T2,恒压下温度越高α(A)越大,说明升高温度平衡向又移动,正反应为吸热反应,△H>0,则△H-T△S<0,反应不能自发进行。

【题目】根据下列实验或实验操作和现象,所得结论正确的是:
选项 | 实验或实验操作 | 现象 | 实验结论 |
A | 用大理石和盐酸反应产生的气体立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
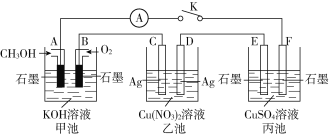
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
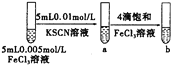
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
【题目】Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
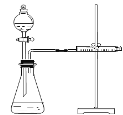
(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。