题目内容
【题目】按下图所示装置进行实验,并回答下列问题:
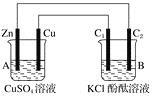
(1)装置的名称:A池为_____________,B池为__________(填电解池、原电池)。
(2)石墨棒C1为________极,电极反应式为________________________________。石墨棒C2附近发生的实验现象_________________________________________________________。反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水) 。
(3)当C2极析出2.24L气体(标准状况下),锌的质量________(增加或减少)________g。
【答案】原电池 电解池 阳极 2Cl--2e-=Cl2↑ 溶液变红 增大 减少 6.5
【解析】
(1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;
(2)锌、铜原电池中,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,据此回答判断.
(3)根据电子守恒解答。
(1)A中金属锌和硫酸铜之间能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)A中锌电极上失电子生成锌离子进入溶液,Zn-2e-=Zn2+,铜电极上铜离子得电子生成铜单质,2e-+Cu2+=Cu,电解池中:C1是阳极,C1上是氯离子失电子析出氯气的过程,2Cl--2e-=Cl2↑;在电解质的阴极上,根据阳离子放电顺序,是氢离子得电子,析出氢气的过程,所以该极附近溶液显示碱性,溶液中酚酞变红;反应结束后,B池溶液的pH值增大;
(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出2.24L气体(标准状态)时,生成氢气的物质的量为n(H2)=2.24L/22.4L·mol-1=0.1mol,则转移的电子为0.2mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.1mol,则锌的质量减少6.5g。

【题目】某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/ kJ·mol-1 | |
硫酸 | 碱溶液 | |||
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(1)实验①中碱液过量的目的是____________________。
(2)甲同学预计ΔH1≠ΔH2,其依据是______________________。
(3)若实验测得①中终了温度为31.8 ℃,则该反应的中和热ΔH1=________(已知硫酸、NaOH溶液密度近似为1.0 g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH________(填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q________。