题目内容
【题目】在生产生活中氮及其化合物的应用和处理已引起广泛关注。
(1)合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。

A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
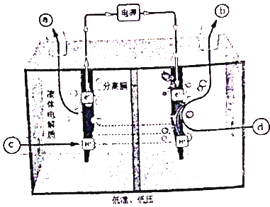
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________。
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g)![]() 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)的ΔH = ________。
4N2(g)+6H2O(g)的ΔH = ________。
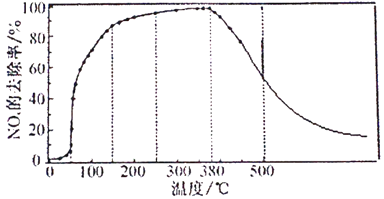
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___
【答案】ACD 0.5 N2 + 6H++6e- = 2NH3 -1630.6 kJ/mol 快速下降:催化剂活性下降;发生了副反应,NH3与O2反应生成了NO。缓慢下降:温度较高时速率较快,此时反应已达平衡,因反应放热,随温度升高平衡左移 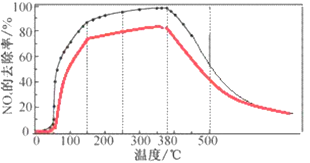
【解析】
(1)根据反应达到平衡时,各组分的物质的量、百分含量保持不变进行分析;同温同压下,体积之比等于物质的量之比,据此计算平衡后反应混合气体的物质的量,利用差量法计算参加反应的氮气的物质的量,再利用三段式计算平衡时各组分的物质的量,计算各组分平衡浓度,代入平衡常数表达式计算;
(2)电解池原理中,阴极区氮气发生还原反应生成氨气;
(3)根据盖斯定律分析计算;
(4)刚开始时催化剂活性降低且有副产物,反应放热,随后温度升高不利于NOx的去除,据此分析作答。
(1)A. 容积可变的密闭容器,当活塞不在移动,说明各组分的浓度和体积不再发生变化,即达到平衡状态,故A项正确;
B. 容积可变的密闭容器内气体的压强始终不变,则气体的压强不变不能说明是否已达到平衡状态,故B项错误;
C. 容器内气体密度 = ![]() ,因气体的总质量保持不变,气体的体积随着反应的进行会发生变化,因此当容器内气体密度保持不变时,说明已经达到平衡状态,故C项正确;
,因气体的总质量保持不变,气体的体积随着反应的进行会发生变化,因此当容器内气体密度保持不变时,说明已经达到平衡状态,故C项正确;
D. 平均分子质量 = ![]() ,反应体系是气体的总物质的量减小的反应,因此当容器内的气体平均分子质量保持不变时,说明已经达到平衡状态,故D项正确;
,反应体系是气体的总物质的量减小的反应,因此当容器内的气体平均分子质量保持不变时,说明已经达到平衡状态,故D项正确;
故答案选ACD。
同温同压下,气体的体积之比等于物质的量之比,因气体的体积从图示1到图示2减少量为10 L-8 L = 2 L,则气体物质的量减少![]() × 2 L = 4 mol,则
× 2 L = 4 mol,则
N2(g)+3H2(g)![]() 2NH3(g) 物质的量减少△n
2NH3(g) 物质的量减少△n
1 2
n(N2) 4 mol
故n(N2)=4mol×![]() = 2mol,列出三段式如下:
= 2mol,列出三段式如下:
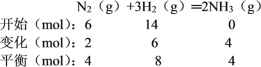
则8 L的容器内所得的氮气、氢气、氨气的平衡浓度分别为0.5mol/L、1mol/L、0.5mol/L,根据平衡常数的定义可知,K = ![]() = 0.5,
= 0.5,
故答案为:ACD;0.5;
(2)根据题意,将电解产生的活性氢作为中间产物直接还原氮气,其阴极发生还原反应,电极反应式为:N2 + 6H++6e- = 2NH3,
故答案为:N2 + 6H++6e- = 2NH3;
(3)①4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol ①;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol ①;
N2(g)+ O2(g)![]() 2NO(g) ΔH2 = +180.8 kJ/mol ②,
2NO(g) ΔH2 = +180.8 kJ/mol ②,
根据盖斯定律可知,反应①-2反应②即可得到目标化学反应方程式4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g)+6H2O(g),即ΔH = ΔH1-2ΔH2 = -1269.0 kJ/mol - 2×180.8 kJ/mol = -1630.6 kJ/mol,
4N2(g)+6H2O(g),即ΔH = ΔH1-2ΔH2 = -1269.0 kJ/mol - 2×180.8 kJ/mol = -1630.6 kJ/mol,
故答案为-1630.6 kJ/mol;
②快速下降的原因为:催化剂活性下降;发生了副反应,NH3与O2反应生成了NO。缓慢下降:温度较高时速率较快,此时反应已达平衡,因反应放热,随温度升高平衡左移,
故答案为:快速下降:催化剂活性下降;发生了副反应,NH3与O2反应生成了NO。缓慢下降:温度较高时速率较快,此时反应已达平衡,因反应放热,随温度升高平衡左移,;
③同一温度下反应到8 min 时NOx的初始浓度较10 min的高,则去除率比反应10 min的去除率略低,最终去除率趋于一致,其变化曲线如下(红线部分):
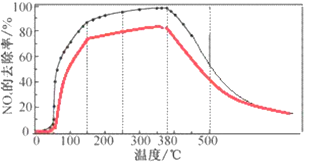 ,
,
故答案为:

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】实验室有一瓶未知浓度的Na2S2O3,通过下列实验测定其浓度
①取10.0 mL Na2S2O3于锥形瓶中,滴入指示剂2—3滴。
②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1的I2溶液润洗,然后注入该标准溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3 =2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是__________。
(2)步聚③达到滴定终点的判断__________________________________。
(3)己知消耗标准液实验数据如下表:
实验次数 | 始读数(ml) | 末读数(ml) |
1 | 0.10 | 19.20 |
2 | 1.85 | 20.75 |
3 | 0.00 | 24.06 |
则废水中的Na2S2O3物质的量浓度为_______________。
(4) 下列操作会导致测定结果偏高的是_________。
A.滴定管在装液前未用标准溶液润洗
B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数