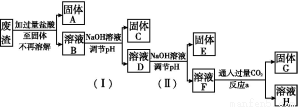
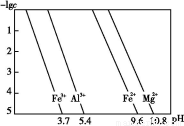
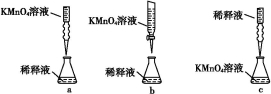
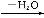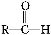题目内容
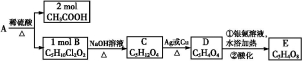
化合物F首先由德国化学家合成,目前常用于制炸药、染料等。以下是其合成过程:
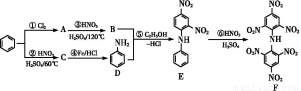
回答下列问题:
(1)化合物E的分子式是 ,化合物F的核磁共振氢谱上有 个峰。
(2)①的反应条件是 ,②的加热方式通常采用 ,④的反应类型是 。
(3)写出⑥反应的化学方程式: 。
(4)化合物G是B的同分异构体,且满足下列要求:①与B具有相同的官能团,②苯环上的一元取代产物只有两种,试写出F的结构简式 、 。
(5)已知化合物D具有弱碱性,能与盐酸反应生成盐,试写出该反应的离子方程式: 。
(1)C12H9N3O4 2
(2)Fe(或FeCl3) 水浴加热 还原反应
(3)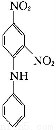 +4HNO3
+4HNO3
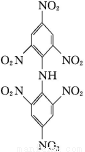 +4H2O
+4H2O
(4)

(5)H++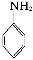


【解析】(1)由E的结构简式写出分子式,化合物F是一对称结构,苯环上只有一类H原子,而N原子上的H原子是另一类,故有2种环境的氢原子,故氢谱上有2个峰。
(2)①是苯与Cl2的取代反应,故条件是Fe或FeCl3作催化剂;②苯的硝化反应是在60℃时进行,故采用水浴加热;C生成D时将硝基还原为氨基,故反应类型为还原反应。
(3)反应⑥为苯环上的H原子被硝基取代的反应,由框图可推知共有四个硝基取代了苯环上的H原子,由此写出方程式即可。
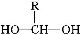
(4)结合E的结构可知B的结构为 ,当苯环上的一元取代物只有两种时,说明苯环只有两种环境的氢原子,故两个硝基处于间位,而Cl原子可以位于两个硝基的共同邻位
,当苯环上的一元取代物只有两种时,说明苯环只有两种环境的氢原子,故两个硝基处于间位,而Cl原子可以位于两个硝基的共同邻位 ,也可以是Cl原子在两个硝基的共同间位
,也可以是Cl原子在两个硝基的共同间位 。
。
(5)化合物D具有弱碱性的原因是分子中含有氨基,与盐酸反应的实质是氨基与H+反应。