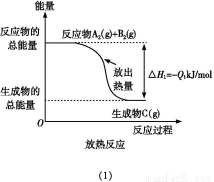
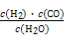题目内容
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
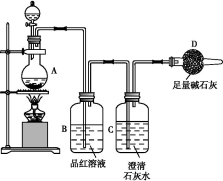
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn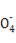 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。
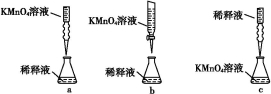
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 。
(1)常温下碳与浓硫酸不反应
(2)铁、碳在酸溶液中形成原电池
(3)检验SO2的存在
(4)C+2H2SO4(浓)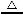 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)酸性KMnO4溶液或溴水(或其他合理答案) 品红溶液
品红溶液不褪色或无明显现象
(6)①250 mL容量瓶 ②b ③不需要 ④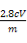 ×100%
×100%
【解析】(1)合金中碳性质不活泼,在常温下与浓硫酸不发生反应;(2)反应一段时间后,浓硫酸变成稀硫酸,铁、碳和稀硫酸发生原电池反应;(3)装置B中品红溶液用于检验反应产物SO2;(4)碳与浓硫酸在加热条件下发生氧化还原反应,化学方程式为C+2H2SO4(浓)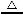 CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn
CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn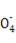 ),合金中铁的质量分数为w(Fe)=
),合金中铁的质量分数为w(Fe)=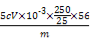 ×100%=
×100%=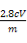 ×100%。
×100%。

某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。