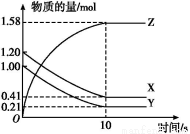
题目内容
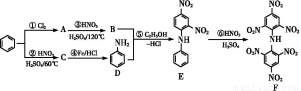
某工业废渣的主要成分为SiO2、Fe2O3、Al2O3、MgO。现根据下列方案对其进行处理以回收废渣中的金属元素。
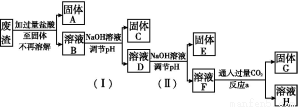
回答下列问题。
(1)固体A的化学式为 。
(2)反应a的化学反应方程式为 。
(3)25 ℃时,溶液中金属离子的物质的量浓度与溶液pH的关系如图所示:
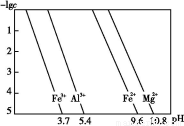
①调节pH(Ⅰ)的pH为 ;
②溶液D加入氢氧化钠溶液的同时调节pH(Ⅱ)所发生反应的离子方程式为 ;
③从图中数据计算可得Mg(OH)2的溶度积Ksp[Mg(OH)2]约为 。
(1)SiO2
(2)NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3
Al(OH)3↓+NaHCO3
(3)①3.7 ②Al3++4OH- Al
Al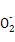 +2H2O、Mg2++2OH-
+2H2O、Mg2++2OH- Mg(OH)2↓ ③10-11.4
Mg(OH)2↓ ③10-11.4
【解析】(1)SiO2、Fe2O3、Al2O3、MgO中只有二氧化硅不溶于盐酸,所以A是二氧化硅。(2)通入二氧化碳能生成沉淀的只有偏铝酸钠。(3)根据金属离子的物质的量浓度与溶液pH的关系,可知调节pH=3.7时Fe3+完全沉淀,而Al3+、Mg2+还没有开始沉淀,而pH=10.8时Mg2+完全沉淀,铝离子转变为Al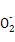 。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。
。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。

某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。