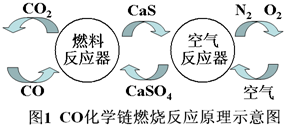
题目内容
18.科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的.下列判断错误的是( )| A. | 处理过程中,PH减小 | B. | 废水处理中,亚硝酸盐被还原 | ||
| C. | 废水处理时铝单质转化为AlO2- | D. | 铝粉颗粒大小影响废水处理的速率 |
分析 A.处理过程中,发生的反应为2Al+2NO2-=N2+2AlO2-,据此判断;
B.铝和亚硝酸盐发生氧化还原反应,铝被氧化,则亚硝酸盐被还原;
C.处理过程中,OH-与Al、NO2-反应,生成N2、AlO2-和H2O;
D.铝粉颗粒度越小,表面积越大,反应速率越大.
解答 解:A.处理过程中,发生的反应为2Al+2NO2-=N2+2AlO2-,溶液的PH无明显变化,故A错误;
B.铝和亚硝酸盐发生氧化还原反应,铝被氧化,则亚硝酸盐被还原,故B正确;
C.处理过程中,OH-与Al、NO2-反应,生成N2、AlO2-和H2O,铝单质转化为AlO2-,故C正确;
D.铝粉颗粒度越小,表面积越大,反应速率越大,所以铝粉颗粒大小影响废水处理的速率,故D正确.
故选A.
点评 本题考查沸水处理,侧重于化学与生活、环境的考查,有利于培养学生的良好的科学素养、提高学生的学习的积极性,注意从元素化合价的角度认识氧化还原反应的有关问题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.硼镁泥是硼镁矿(主要成分:MgO•B2O3)生产硼砂(Na2B4O7)的废渣,生产原理如下:2MgO•B2O3+Na2CO3+CO2=Na2B4O7+2MgCO3.硼镁泥中的MgCO3是宝贵的镁资源.某研究小组以硼镁泥为原料提取MgSO4•7H2O,设计了如下流程图:

各离子开始沉淀和完全沉淀的pH值
请回答下列问题:
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;
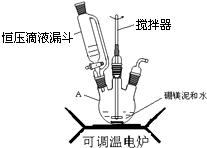
(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.

各离子开始沉淀和完全沉淀的pH值
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |

请回答下列问题:
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;

(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.
9.在一个2L的恒容密闭容器中发生反应:A(s)+4B(g)═C(g)+3D(g),10min末,B的物质的量减少2mol,下列有关该反应的表述中正确的是( )
| A. | 0-10min内,用A表示的平均反应速率是0.05mol•L-1•min-1 | |
| B. | 0-10min内,用B表示的平均反应速率是0.01mol•L-1•min-1 | |
| C. | 分别用B、C、D表示反应的速率,其比值是4:3:1 | |
| D. | 随着反应的进行,容器内气体压强始终保持不变 |
13.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
3.由两种烃组成的混合气体2L与足量的氧气充分反应后生成5LCO2、6LH2O(所有体积都在120℃测定),则这两种混合气体的可能组成是( )
| A. | C2H4、C3H8 | B. | CH4、C3H8 | C. | CH4、C4H10 | D. | C2H2、C3H8 |
7.下列有关元素周期表的叙述正确的是( )
| A. | 同周期主族元素,原子半径随原子序数增大而增大 | |
| B. | 第3周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 周期表中所含元素种类最多的族是ⅠA族 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
8.在反应:H2+CuO═Cu+H2O 中,H2是( )
| A. | 还原剂 | B. | 氧化剂 | C. | 还原产物 | D. | 氧化产物 |