题目内容
3.氨及其盐对农业生产有着重要的意义,也是重要的化工原料.(1)常温下向V1mL0.1mol/L氨水中逐滴加入V2mL0.1mol/L盐酸,当溶液PH=7时,V1>V2(填“>”、“=”或“<”);当V1:V2=2:1时,溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(2)氨经一系列反应可制得硝酸,其中最重要的一步反应是:
4NH3(g)+5O2(g)$?_{450℃}^{Pa-Rb}$4NO(g)+6H2O(g),△H<0.
在某温度下,向恒容的密闭容器中按物质的量之比为1;2充入NH3和O2,O2的物质的量浓度随时间的变化关系如图1所示.
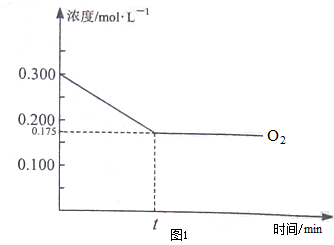
①若升高反应体系的温度,该反应的平衡常数K减小(填“增大”、“减小”或“不变”).
②平衡时NO的体积分数为21.05%.
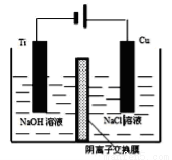
(3)一定条件下,图2所示装置可实现电化学合成氨(气体体积在相同状况下测定).
①电源的正极是A极(填“A”或“B”).
②阴极的电极反应式为N2+6e-+6H+═2NH3.
③N2的转化率为$\frac{2a}{3b-2a}$×100%(用a、b表示).

分析 (1)向V1mL0.1mol/L氨水中逐滴加入V2mL0.1mol/L盐酸生成氯化铵,因为氯化铵是强酸弱碱盐,其溶液呈酸性,所以当溶液PH=7时,氨水要过量一些;
当V1:V2=2:1时,反应后溶液为等量的氯化铵和氨水,溶液显碱性,再结合电荷守恒判断铵根离子和氯离子浓度大小;
(2)①根据该反应为放热反应,则升高反应体系的温度,平衡逆向移动,所以该反应的平衡常数K减小;
②应用三段式,平衡时NO的体积分数=$\frac{n(NO)}{n(总)}$进行计算;
(3)根据电解图,右边氮气得电子生成氨气,所以为阴极,则B为负极,A为正极,所以左边为阳极发生氧化反应,据此分析计算;
解答 解:(1)向V1mL0.1mol/L氨水中逐滴加入V2mL0.1mol/L盐酸生成氯化铵,因为氯化铵是强酸弱碱盐,其溶液呈酸性,所以当溶液PH=7时,氨水要过量一些,所以消耗氢氧化钠体积V1>V2;
当V1:V2=2:1时,反应后溶液为等量的氯化铵和氨水,溶液显碱性,c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>C(Cl-),所以溶液中离子浓度大小顺序是cc(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:>;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)①因为该反应为放热反应,则升高反应体系的温度,平衡逆向移动,所以该反应的平衡常数K减小,故答案为:减小;
②由图象可知,氧气开始时浓度为0.3mol/L,平衡时为0.175moL/L,则
4NH3(g)+5O2(g)$?_{450℃}^{Pa-Rb}$4NO(g)+6H2O(g),
开始 0.15 0.3 0 0
反应 0.1 0.125 0.1 0.15
转化0.05 0.175 0.1 0.15
所以平衡时NO的体积分数=$\frac{n(NO)}{n(总)}$=$\frac{0.1}{0.1+0.175+0.05+0.15}$=21.05%,故答案为:21.05%;
(3)①根据电解图,右边氮气得电子生成氨气,所以为阴极,则B为负极,A为正极,故答案为:A;
②根据电解图,右边氮气得电子生成氨气,所以为阴极,反应式为:N2+6e-+6H+═2NH3,故答案为:N2+6e-+6H+═2NH3;
③根据电解图,右边氮气得电子生成氨气,所以为阴极,反应式为:N2+6e-+6H+═2NH3,左边为阳极发生氧化反应,反应式为4OH--4e-═O2+2H2O,又阳极生成aL氧气则转移$\frac{a}{22.4}$×4mol=$\frac{a}{5.6}$mol电子,根据得失电子守恒则阴极生成氨气为$\frac{\frac{a}{5.6}}{6}$×2=$\frac{a}{16.8}$mol,所以剩余N2的体积为b-$\frac{a}{16.8}$×22.4=b-$\frac{4}{3}$a;反应消耗的氮气为$\frac{a}{16.8}$×$\frac{1}{2}$×22.4=$\frac{2}{3}$a,则N2的转化率为$\frac{\frac{2}{3}a}{\frac{2}{3}a+b-\frac{4}{3}a}$×100%=$\frac{2a}{3b-2a}$×100%;故答案为:$\frac{2a}{3b-2a}$×100%;
点评 本题考查了溶液中离子浓度的比较,化学平衡的判断与计算以及电解原理的分析应用,电子转移计算应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
 应制取H2,反应方程式如下:
应制取H2,反应方程式如下:
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题: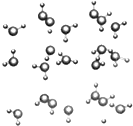 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):