题目内容
1.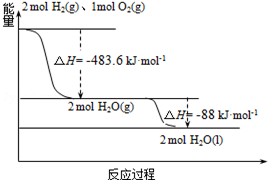 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
| A. | 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 |
分析 A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量;
C.由图象分析,2H2(g)+O2(g)═H2O(l)△H1=-483.6kJ•mol-1①,
H2(g)=H2(l)△H1=-0.92kJ•mol-1②
O2(g)=O2(l)△H2=-6.84kJ•mol-1③
将①-②×2-③×2利用盖斯定律计算;
D.H2O(g)生成H2O(l)时,放出热量,故断键吸收的能量小于成键放出的能量
解答 解:A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量,故2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高,故A错误;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为$\frac{483.6+88}{2}$=285.8kJ•mol-1,故B错误;
C.由图象分析,2H2(g)+O2(g)═H2O(l)△H1=-483.6kJ•mol-1①,
H2(g)=H2(l)△H1=-0.92kJ•mol-1②
O2(g)=O2(l)△H2=-6.84kJ•mol-1③
将①-②×2-③×2可得2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1,故C正确;
D.H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂和生成,故D错误;
故选C.
点评 本题综合考查化学反应与能量变化知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握燃烧热的定义以及盖斯定律的应用,难度不大.

练习册系列答案
相关题目
12.氯酸是一种强酸,常温下浓度超过40%时会发生分解,反应可表示为:aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
9.下列叙述不正确的是( )
| A. | 因为氯气具有酸性,所以可与烧碱或石灰乳反应制备含氯消毒剂 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 | |
| C. | 过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:2 | |
| D. | 植物油的不饱和程度高于动物油,植物油更易氧化变质 |
13.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
10.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液滴入热水中制Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3(胶体) | |
| B. | ICl溶于冷的稀KOH溶液中:ICl+2OH-═Cl-+IO-+H2O | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+2H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:HC${{O}_{3}}^{-}$+Ca2++OH-═CaCO3↓+H2O |
8.下列组合判断正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
| A. | ①②不正确,③④⑤正确 | B. | ①②③④⑤均不正确 | ||
| C. | ①②正确,③④⑤不正确 | D. | ①②③④正确 |
 .
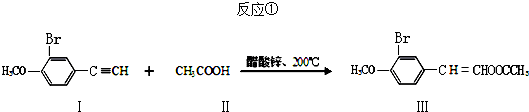
.
 (任写其中一种)
(任写其中一种) 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3. .利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式
.利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 .
.