题目内容
12.下列说法正确的是( )| A. | 1mol Cl2与足量Fe反应,转移电子的物质的量为3mol | |
| B. | 工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子 | |
| C. | 称取25g CuSO4•5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25% | |
| D. | NO和NO2的混合气体共1mol,其中氮原子数为2mol |
分析 A.根据转移电子=化合价变化×物质的量计算;
B.根据转移电子=化合价变化×物质的量计算;
C.根据溶液中溶质的质量分数=$\frac{硫酸铜的质量}{溶液总质量}$×100%计算;
D.根据一个分子中含1个氮原子判断.
解答 解:A.1mol Cl2与足量Fe反应,Cl元素由0价降低为-1价,所以1mol Cl2与足量Fe反应,转移电子的物质的量为2mol,故A错误;
B.由方程式可知,每生成1molSO2,有1mol硫被氧化生成SO2,转移电子为1mol×[4-(-2)]=6mol,故B正确;
C.称取25gCuSO4•5H2O固体溶于75g水中,则含硫酸铜为25×$\frac{160}{250}$=16g,则所得溶液中溶质的质量分数为16%,故C错误;
D.因为无论NO还是二氧化氮还是NO和NO2的混合气体都是一个分子中含1个氮原子,所以NO和NO2的混合气体共1mol,其中氮原子数为1mol,故D错误.
故选B.
点评 本题考查氧化还原反应中转移电子数的计算以及溶液中溶质的质量分数的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,注意转移电子=化合价变化×物质的量,题目难度不大.

练习册系列答案
相关题目
7.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L-1 |
17.物质的量浓度相同的下列溶液中,含粒子种类最多的是( )
| A. | K2CO3 | B. | CH3COONa | C. | NH4Cl | D. | CaCl2 |
4.下列有关金属的腐蚀的说法中,不正确的是( )
| A. | 纯银饰品久置表面变暗属于化学腐蚀 | |
| B. | 温度越高,金属发生化学腐蚀的速率越快 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 铁门上的铜铆钉处在潮湿的空气中直接发生反应:Fe-3e-═Fe3+ |
1.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的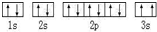 B电子排布图如图,违背了泡利原理.
B电子排布图如图,违背了泡利原理.
(3)CD3中心原子的杂化方式为sp3,分子立体构型三角锥形形.
(4)E元素基态原子的电子占用15个原子轨道,有26种不同运动状态.
(5)F元素的元素符号为As,其基态原子的核外电子排布式1s22s22p63s23p63d104s24p3.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E元素的+3价离子有5个未成对电子 |
| F在周期表的第15列 |
(2)某同学根据上述信息,所画的
 B电子排布图如图,违背了泡利原理.
B电子排布图如图,违背了泡利原理.(3)CD3中心原子的杂化方式为sp3,分子立体构型三角锥形形.
(4)E元素基态原子的电子占用15个原子轨道,有26种不同运动状态.
(5)F元素的元素符号为As,其基态原子的核外电子排布式1s22s22p63s23p63d104s24p3.
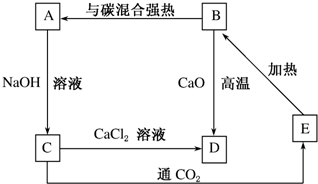
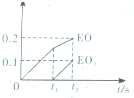 将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.