题目内容
2.(1)常温下:有pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入蒸馏水稀释至900毫升或加入pH=3的HCl溶液450毫升(混合溶液体积变化忽略不计).(2)一定温度下:有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c来回答).当其物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c.同体积、同物质的量浓度的二种酸溶液,中和NaOH的能力由大到小的顺序为b>a=c.
分析 (1)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;先根据盐酸的pH计算氢离子浓度,再根据c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$计算;
(2)HCl为一元强酸,H2SO4为二元强酸,而CH3COOH为弱酸,物质的量浓度相同时,c(H+)关系:硫酸>盐酸>醋酸;盐酸和醋酸为一元酸,二者中和的氢氧化钠的体积相同,硫酸是二元酸,消耗氢氧化钠的体积为盐酸的2倍.
解答 解:(1)常温下pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L×0.001mol/L,则:V2=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=0.9L=900mL;
pH=3的盐酸的浓度是0.001mol/L,设加入盐酸的体积是VL,c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$=$\frac{0.01mol/L×0.1L-0.001×VL}{(0.1+V)L}$=0.001mol/L,
解得:V=0.45L=450mL,
故答案为:900;450;
(2)HCl为一元强酸,H2SO4为二元强酸,而CH3COOH为弱酸部分电离,物质的量浓度相同时,则c(CH3COOH)>c(H+),c(HCl)=c(H+),c(H2SO4)=0.5c(H+),所以氢离子浓度大小:b>a>c;
同体积同物质的量浓度的三种酸溶液,中和NaOH溶液,盐酸和醋酸为一元酸,二者中和的氢氧化钠溶液的体积相同,而硫酸是二元酸,消耗氢氧化钠的体积为盐酸的2倍,则中和NaOH的能力大小为:b>a=c,
故答案为:b>a>c;b>a=c.
点评 本题考查了酸的浓度与溶液中氢离子浓度的关系,酸碱中和反应的定量比较等知识,题目难度中等,明确酸的酸性强弱及溶液中氢离子的浓度与pH的关系是解答本题的关键.

| A. | 1mol Cl2与足量Fe反应,转移电子的物质的量为3mol | |
| B. | 工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子 | |
| C. | 称取25g CuSO4•5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25% | |
| D. | NO和NO2的混合气体共1mol,其中氮原子数为2mol |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 铝片与稀盐酸反应 | B. | 甲烷在氧气中的燃烧反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 氢气还原三氧化钨 |
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式  | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p6 | |
| D. | 碳-12原子构成${\;}_{6}^{12}$C |
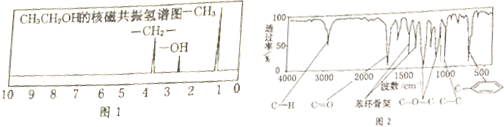
 或
或 .
. .
.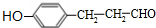 等.
等.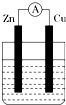 如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液.
如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液.