题目内容
8.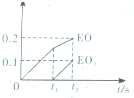 将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
将E单质缓慢通入石灰水中,若生成物中有三种含E元素的离子,其中两种离子的物质的量与反应时间的曲线如图所示,则t1时刻[n(EO-)=0.15mol]消耗氢氧化钙的物质的量为0.15mol,t2时总反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
分析 根据题意知道E是氯气,由图象可知知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知氯气和氢氧化钙的反应方程式,以此计算.
解答 解:由图象可知知,t1时刻[n(EO-)=0.15mol],此时发生的反应为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,当次氯酸根离子是0.15mol,生成次氯酸钙是0.075mol,消耗氢氧化钙的物质的量为0.15mol,t2时,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O,
故答案为:0.15mol;10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
点评 本题考查氯气性质、图象计算与化学方程式的书写、阅读获得信息的能力等,难度较大,读懂图象与信息判断发生的反应是解题的关键.

练习册系列答案
相关题目
18.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.则在上述条件下,下列说法正确的是( )
| A. | 石墨转化为金刚石不属于化学变化 | B. | 石墨比金刚石更稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量高 | D. | 石墨和金刚石是碳元素的同位素 |
5.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际单位制的一个基本物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 表示6.02×1023个粒子的集合体 |
12.下列说法正确的是( )
| A. | 1mol Cl2与足量Fe反应,转移电子的物质的量为3mol | |
| B. | 工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子 | |
| C. | 称取25g CuSO4•5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25% | |
| D. | NO和NO2的混合气体共1mol,其中氮原子数为2mol |
9.下列反应的离子方程式书写正确的是( )
| A. | 过量铁加入到稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO2↑+4H2O | |
| B. | 向AgCl悬浊液中滴加饱和KI溶液 AgCl+I-═AgI+Cl- | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+H2O═2Al(OH)3↓+HCO3- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
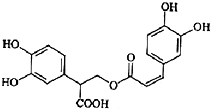 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.