题目内容
【题目】用如图装置探究NH3和CuSO4溶液的反应。
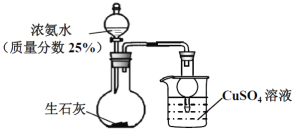
(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O![]() NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
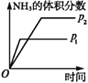
(2) 制备100mL25%氨水(ρ=0.905gcm-3),理论上需要标准状况下氨气______L(小数点后保留一位)。
(3) 上述实验开始后,烧杯内的溶液__________________________,而达到防止倒吸的目的。
(4)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式。_______________________。继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应:2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
①该反应平衡常数的表达式K=___________________________。
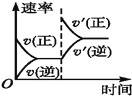
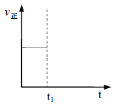
②t1时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中v正的变化___________________。
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:________________________________。
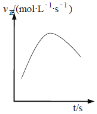
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如下图所示,v正先增大后减小的原因__________________________________。
【答案】NH3H2O![]() NH4++OH- NH3(g)
NH4++OH- NH3(g)![]() NH3(aq)(或氨气的溶解平衡) Ca(OH)2(s)
NH3(aq)(或氨气的溶解平衡) Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)(或Ca(OH)2 的溶解平衡) 29.8 进入干燥管后,又回落至烧杯,如此反复进行 Cu2++2NH3H2O→ Cu(OH)2↓+2NH4+ [[Cu(NH3)4]2+]/[ NH3]2[NH4+] 2
Ca2+(aq)+2OH-(aq)(或Ca(OH)2 的溶解平衡) 29.8 进入干燥管后,又回落至烧杯,如此反复进行 Cu2++2NH3H2O→ Cu(OH)2↓+2NH4+ [[Cu(NH3)4]2+]/[ NH3]2[NH4+] 2  加水,反应物、生成物浓度均降低,但反应物降低更多,平衡左移,生成了更多的Cu(OH)2(加水稀释后c[Cu(NH3)4]2+/c2 (NH3) c2 (NH4+) 会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀 该反应是放热反应,反应放出的热使容器内温度升高,v正 增大;随着反应的进行,反应物浓度减小,v正 减小
加水,反应物、生成物浓度均降低,但反应物降低更多,平衡左移,生成了更多的Cu(OH)2(加水稀释后c[Cu(NH3)4]2+/c2 (NH3) c2 (NH4+) 会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀 该反应是放热反应,反应放出的热使容器内温度升高,v正 增大;随着反应的进行,反应物浓度减小,v正 减小
【解析】
(1) 制备NH3的实验中,存在着NH3+H2O![]() NH3H2O、NH3的溶解平衡和Ca(OH)2 的溶解平衡三个平衡过程;
NH3H2O、NH3的溶解平衡和Ca(OH)2 的溶解平衡三个平衡过程;
(2) 氨水是指NH3的水溶液,不是NH3·H2O的水溶液,所以要以NH3为标准计算. n(NH3)= ![]() =1.33 mol;
=1.33 mol;
(3) 实验开始后,烧杯内的溶液进入干燥管后,又回落至烧杯,如此反复进行,而达到防止倒吸的目的;
(4) NH3通入CuSO4溶液中和水反应生成NH3H2O,NH3H2O电离出OH-,从而生成蓝色沉淀Cu(OH)2;
①反应2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0),平衡常数的表达式K=
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0),平衡常数的表达式K=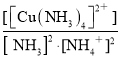 ;
;
②反应2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)是放热反应,降温可以使K增大,正逆反应速率都减少;
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)是放热反应,降温可以使K增大,正逆反应速率都减少;
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:加水,反应物、生成物浓度均降低,但反应物降低更多,平衡左移,生成了更多的Cu(OH)2(加水稀释后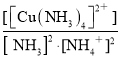 会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀;
会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀;
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正先增大后减小的原因,温度升高反应速度加快,反应物浓度降低反应速率又会减慢。
(1) 制备NH3的实验中,存在着NH3+H2O![]() NH3H2O、NH3的溶解平衡和Ca(OH)2 的溶解平衡三个平衡过程,故答案为:NH3H2O
NH3H2O、NH3的溶解平衡和Ca(OH)2 的溶解平衡三个平衡过程,故答案为:NH3H2O![]() NH4++OH- NH3(g)
NH4++OH- NH3(g)![]() NH3(aq)(或氨气的溶解平衡)、Ca(OH)2(s)
NH3(aq)(或氨气的溶解平衡)、Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)(或Ca(OH)2 的溶解平衡);
Ca2+(aq)+2OH-(aq)(或Ca(OH)2 的溶解平衡);
(2) 氨水是指NH3的水溶液,不是NH3·H2O的水溶液,所以要以NH3为标准计算. n(NH3)= ![]() =1.33 mol,标准状况下体积为1.33mol×22.4L/mol=29.8L;
=1.33 mol,标准状况下体积为1.33mol×22.4L/mol=29.8L;
(3) 实验开始后,烧杯内的溶液进入干燥管后,又回落至烧杯,如此反复进行,而达到防止倒吸的目的;
(4) NH3通入CuSO4溶液中和水反应生成NH3H2O,NH3H2O电离出OH-,从而生成蓝色沉淀Cu(OH)2,该反应的离子方程式为:Cu2++2NH3H2O→ Cu(OH)2↓+2NH4+;
①反应2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0),平衡常数的表达式K=
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0),平衡常数的表达式K=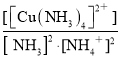 ;
;
②反应2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)是放热反应,降温可以使K增大,正逆反应速率都减少,画出该过程中v正的变化为:
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)是放热反应,降温可以使K增大,正逆反应速率都减少,画出该过程中v正的变化为: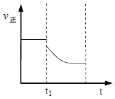 ;
;
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:加水,反应物、生成物浓度均降低,但反应物降低更多,平衡左移,生成了更多的Cu(OH)2(加水稀释后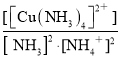 会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀;
会大于该温度下的K,平衡左移,生成了 更多的Cu(OH)2,得到蓝色沉淀;
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正先增大后减小的原因,温度升高反应速度加快,反应物浓度降低反应速率又会减慢,故原因是:该反应是放热反应,反应放出的热使容器内温度升高,v正 增大;随着反应的进行,反应物浓度减小,v正 减小。

【题目】对于可逆反应N2(g)+3H2(g)2NH3(g);△H<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 增加H2的浓度对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.AB.BC.CD.D