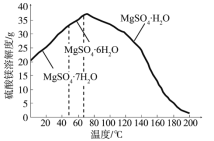
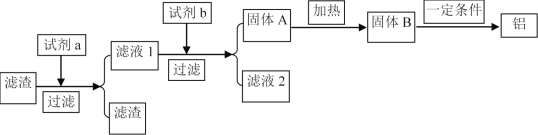
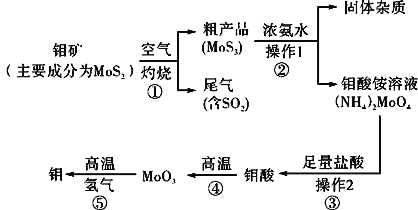
题目内容
【题目】W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为7:17,X与W同主族,Y的原子序数是W和X的原子序数之和的一半,含Z元素的物质在焰色反应实验中的焰色为黄色。下列判断正确的是
A.金属性:Y>ZB.非金属性:W>X
C.原子半径:W>Y>ZD.氢化物的热稳定性:X>W
【答案】D
【解析】
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17,且W是短周期元素,原子序数小于18,所以W是Cl元素;X与W同主族,且X为短周期元素,所以X是F元素;Y的原子序数是W和X的原子序数之和的一半,所以Y的原子序数=![]() ×(9+17)=13,Y是Al元素;含Z元素的物质焰色反应为黄色,Z是Na元素,结合元素周期律分析解答。
×(9+17)=13,Y是Al元素;含Z元素的物质焰色反应为黄色,Z是Na元素,结合元素周期律分析解答。
根据上述分析,W、X、Y、Z分别是Cl、F、Al、Na元素,
A.同一周期元素的金属性随着原子序数的增大而减小,所以Na的金属性大于Al,即金属性:Y<Z,故A错误;
B.同一主族元素的非金属性随着原子序数的增大而减小,所以F的非金属性大于Cl,即非金属性:W<X,故B错误;
C.同一周期元素的原子半径随着原子序数的增大而减小,所以原子半径:Z>Y>W,故C错误;
D.同一主族元素的非金属性随着原子序数的增大而减小,F的非金属性大于Cl的非金属性,所以氢化物的稳定性:X>W,故D正确;
答案选D。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目