题目内容
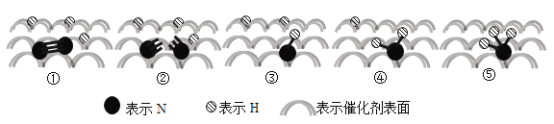
【题目】科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。
完成下列填空:

(1)硅原子最外电子层有________种运动状态不同的电子,占据______个轨道。
(2)由题意可推知Y是Cl,推得此结论的依据是__________________。X和Si之间共用电子对偏离________。
(3)SiCl4和CCl4分子空间结构相同,则SiCl4中键角是_________。请说明SiCl4和CCl4沸点高低的理由。__________________________________________。
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),补全并配平该反应的化学方程式,标出电子转移的数目和方向:_____P4+_____NaOH+_________→_____PH3↑+_____NaH2PO2,____________________.其中氧化剂和还原剂质量比为________。根据题意可判断H3PO2是________元酸(填“一”、“二”或“三”)。
(5)已知磷酸二氢钠(NaH2PO4)溶液呈酸性,该溶液中含磷元素的离子浓度由大到小的顺序是:__________________________________________。
【答案】4 3 Y在第三周期,且Y 和Si 间只有一根共价键 Si 109°28′ SiCl4 的熔点比CCl4 高,SiCl4 和CCl4 是组成和结构相似的分子晶体,SiCl4 的相对分子质量大,分子间作用力强,故SiCl4 的熔点高 1 3 3H2O 1 3 ![]() 1:3 一 c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)
1:3 一 c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)
【解析】
(1)Si原子的电子排布式为1s22s22p63s23p2,最外层含有4个电子,4个电子的运动状态均不同;
(2)Y 和Si 间只有一根共价键且在第三周期,则Y是Cl;X周围连接了2根共价键,又在第三周期,则X是S元素;
(3) SiCl4和CCl4分子空间结构相似;
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),P的化合价由0价下降到-3价,同时又从0价上升到+1价,P4既是氧化剂又是还原剂,还原产物PH3 和氧化产物NaH2PO2的系数比为1:3,该反应共转移电子3个,配平该反应的化学方程式,标出电子转移的数目和方向;
(5) 已知磷酸二氢钠(NaH2PO4)溶液中NaH2PO4是三元酸,分三步电离且电离程度越来越小,分别生成H2PO4﹣、HPO42﹣和PO43﹣。
(1)Si原子的电子排布式为1s22s22p63s23p2,最外层含有4个电子,4个电子的运动状态均不同,所以最外层有4种运动状态不同的电子,占据1个3s轨道和2个3p轨道,共占据3个轨道;
(2)Y 和Si 间只有一根共价键且在第三周期,则Y是Cl;X周围连接了2根共价键,又在第三周期,则X是S元素,S元素的电负性比Si元素大,则X和Si之间共用电子对偏离Si;
(3)SiCl4和CCl4分子空间结构相似,都是正四面体结构,SiCl4中键角是109°28′;SiCl4 和CCl4 是组成和结构相似的分子晶体,SiCl4 的相对分子质量大,分子间作用力强,故SiCl4 的熔点高;
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),P的化合价由0价下降到-3价,同时又从0价上升到+1价,P4既是氧化剂又是还原剂,还原产物PH3 和氧化产物NaH2PO2的系数比为1:3,该反应共转移电子3个,配平该反应的化学方程式,标出电子转移的数目和方向为:![]() ;其中氧化剂和还原剂质量比为1:3;H3PO2在水中只能电离出一个氢离子,故次磷酸是一元酸;
;其中氧化剂和还原剂质量比为1:3;H3PO2在水中只能电离出一个氢离子,故次磷酸是一元酸;
(5) 已知磷酸二氢钠(NaH2PO4)溶液中NaH2PO4是三元酸,分三步电离且电离程度越来越小,分别生成H2PO4﹣、HPO42﹣和PO43﹣,浓度关系为:c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)。