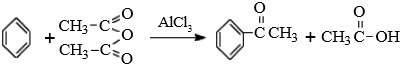
题目内容
9.根据下列微粒回答问题(填序号):①${\;}_{1}^{1}$H ②${\;}_{1}^{2}$H ③${\;}_{1}^{3}$H ④14C ⑤14N ⑥16O ⑦35Cl2 ⑧37Cl2
(1)以上8种微粒共有6种核素,属于5种元素.
(2)互为同位素的是①②③.
(3)质量数相等的是④⑤,中子数相等的是④⑥.
(4)形成的水分子共有6种.
分析 (1)质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
(2)质子数相同,而中子数不同的原子,互称为同位素;
(3)原子符号左上角的数字为质量数;中子数=质量数-质子数;
(4)根据水的组成是由氢、氧元素组成,在1个水分子中含有2个氢原子和1个氧原子来分析解答.
解答 解:(1)质子数和中子数只要其一不相同就属于不同核素:
①${\;}_{1}^{1}$H ②${\;}_{1}^{2}$H ③${\;}_{1}^{3}$H ④14C ⑤14N ⑥16O 分别为一种核素,共6种;
①${\;}_{1}^{1}$H ②${\;}_{1}^{2}$H ③${\;}_{1}^{3}$H 都属于氢元素,④14C 属于碳元素,⑤14N 属于氮元素,⑥16O属于氧元素,⑦35Cl2 和⑧37Cl2都属于氯元素,一共有5种元素;
故答案为:6;5;
(2)其中①${\;}_{1}^{1}$H ②${\;}_{1}^{2}$H ③${\;}_{1}^{3}$H 都属于氢元素,质子数相同,而中子数不同互为同位素;
故答案为:①②③;
(3)原子符号左上角的数字为质量数,则质量数相等的是④14C和 ⑤14N;④14C 中中子数=14-6=8,⑥16O 的中子数=16-8=8,所以二者中子数相同;
故答案为:④⑤;④⑥;
(4)氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水,相对分子质量不同分别为:18,20,22;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水,相对分子质量不同分别为:19,21,20;
故答案为:6.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及核外电子数的计算,难度不大,掌握概念即可完成.

 备战中考寒假系列答案
备战中考寒假系列答案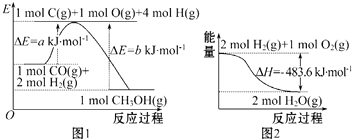
| A. | 根据图 1 可知合成甲醇的热化学方程式为CO(g)+2H2 (g)=CH 3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图 2 表示 2 mol H2(g)所具有的能量比 2 mol气态水所具有的能量多 483.6 kJ | |
| C. | 1 mol NaOH 分别和 1 mol CH3COOH、1 mol HNO3 反应,后者比前者△H 小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
| A. | 同主族金属元素的原子半径越大,熔点越高 | |
| B. | 离子晶体固态或熔融状态下都能导电 | |
| C. | 原子最外层有3个电子的元素一定是主族元素 | |
| D. | 温度越高,金属晶体的导电性越好 |
| A. | 19种 | B. | 10种 | C. | 16种 | D. | 12种 |
| A. | 碳水化合物都符合通式Cn(H2O)m | |
| B. | 符合通式Cn(H2O)m的物质都是糖类 | |
| C. | 糖类物质都有甜味 | |
| D. | 糖类是人类维持生命的六大营养素之一 |
| A. | Cl2与H2S溶液发生置换反应 | B. | 受热时H2S能分解,HCl则不能 | ||
| C. | 单质硫可在空气中燃烧,Cl2不能 | D. | 溶于水时HCl是强酸,H2S是弱酸 |