题目内容
19.不能说明氯元素的非金属性比硫元素强的事实是( )| A. | Cl2与H2S溶液发生置换反应 | B. | 受热时H2S能分解,HCl则不能 | ||
| C. | 单质硫可在空气中燃烧,Cl2不能 | D. | 溶于水时HCl是强酸,H2S是弱酸 |
分析 比较非金属性的强弱,可根据①氢化物的稳定性,②最高价氧化物对应的水化物的酸性,③对应的单质的氧化性,④单质之间的置换反应⑤与氢气反应的剧烈程度等判断.
A.元素的非金属性越强,对应单质的氧化性越强,同一反应氧化剂氧化性大于氧化产物;
B.元素的非金属性越强,对应氢化物的稳定性越强;
C.单质硫可在空气中燃烧,硫的非金属性弱于氧,Cl2不能,氯的非金属性强于氧;
D.比较非金属性的强弱,不能根据氢化物的酸性进行比较.
解答 解:A.Cl2与H2S溶液发生Cl2+H2S=S↓+2HCl,氯气为氧化剂,硫为氧化产物,氯气与H2S能发生置换反应,同一反应氧化剂氧化性大于氧化产物,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故A不选;
B.元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,可说明非金属性:Cl>S,故B不选;
C.硫和氧气反应生成二氧化硫,硫被氧化,Cl2不能,氯的非金属性强于氧,可说明非金属性:Cl>S,故C不选;
D.比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故D选;
故选D.
点评 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.

练习册系列答案
相关题目
10.电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于电负性的变化规律正确的是( )
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
9.下列离子反应方程式正确的是( )
| A. | 澄清石灰水来吸收氯气:Cl2+OH-═Cl-+ClO-+H+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 在碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
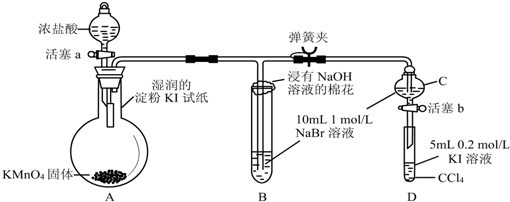
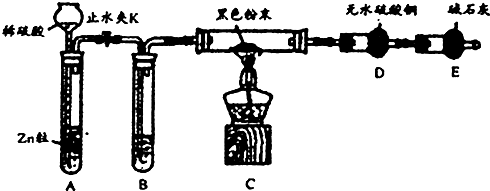
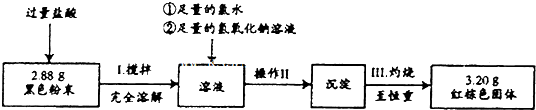
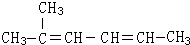 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.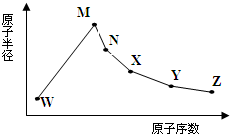 W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.
W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.