题目内容
1.苯乙酮的制备原理及装置图如图: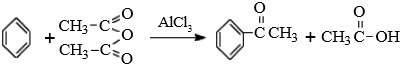
已知:①制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.
②苯乙酮微溶于水,易溶于苯等有机溶剂.
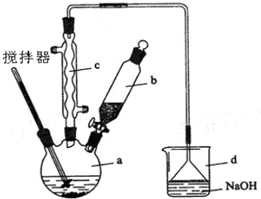
主要步骤:
(Ⅰ)合成:在100mL 三颈瓶中加入13g无水AlCl3和16mL无水苯,边搅拌边慢慢滴4mL乙酸酐,滴加完毕后水浴加热直到没有HCl气体逸出为止.
(Ⅱ)分离与提纯:
①反应混合物边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,再分液得到有机层
②水层继续用苯萃取两次,每次8mL.
③将①②所得有机层合并,洗涤,干燥,蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮,回答下列问题:
(1)装置c的作用:冷凝回流原料;装置d中漏斗的作用:防止倒吸.
(2)分离与提纯操作中第①步滴加一定量浓盐酸和冰水的主要目的是溶解铝盐,写出这步操作中滴加浓盐酸的另外一个作用把溶解在水中的苯乙酮提取出来以减少损失.
(3)分离与提纯的操作中第二步②的目的是把溶解在水中的苯乙酮提取出来以减少损失,该操作中不能用乙醇萃取的原因是乙醇与水互溶.
(4)使用分液漏斗萃取时,先后加入待萃取剂,经振摇,静置,分层,分液时苯层的具体操作为从分液漏斗上口倒出.
分析 (1)依据装置图中的仪器以及反应的特点判断仪器的名称和作用;
(2)此反应存在CH3COOH+AlCl3→CH3COOAlCl2+HCl↑副反应,加入浓盐酸,可以使此副反应逆向移动;
(3)依据萃取的原理是利用物质在互不相溶的溶剂中 的溶解度不同,对混合溶液进行分离;
(4)分液操作的本质和注意问题分析判断.
解答 解:(1)仪器c为冷凝管,在此反应中反应物乙酸容易挥发,故c的作用是冷凝回流,由于HCl气体极易溶解于水,采用倒扣的漏斗可以防止倒吸,
故答案为:冷凝回流;防倒吸;
(2)由于此制取过程中存在CH3COOH+AlCl3→CH3COOAlCl2+HCl↑副反应,加入浓盐酸可以使此逆反应逆向移动,故盐酸的作用是:把溶解在水中的苯乙酮提取出来以减少损失,故答案为:把溶解在水中的苯乙酮提取出来以减少损失;
(3)水层用苯萃取并分液的目的是把溶解在水中的苯乙酮提取出来以减少损失,由于乙醇能与水混溶不分层,所以不能用酒精代替苯进行萃取操作;
故答案为:把溶解在水中的苯乙酮提取出来以减少损失;乙醇与水互溶;
(4)分液时,下层液体从下面放出,由于苯的密度小于水,苯层在上层,为避免液体污染,应从上层倒出,故答案为:从分液漏斗上口倒出.
点评 本题考查了物质制备、分离、提纯、萃取剂选择、仪器使用等试验基础知识的应用,化学实验基本知识和基本技能的掌握是解题关键,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
12.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18 | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
9.下列说法正确的是( )
| A. | 第三周期非金属元素的含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从上到下依次减弱 | |
| C. | 在ⅥA族元素的氢化物(H2R)中,沸点最高的一定是无毒的 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点也一定越高 |
13.H2O在通电条件下会发生分解生成H2和O2.现有水1H218O在通电条件下发生分解,生成氢气和氧气的质量比为( )
| A. | 1:9 | B. | 1:36 | C. | 1:8 | D. | 8:9 |
10.电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于电负性的变化规律正确的是( )
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |