题目内容
20.下列表述中正确的是( )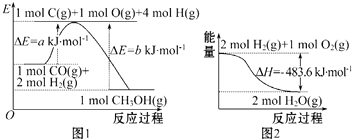
| A. | 根据图 1 可知合成甲醇的热化学方程式为CO(g)+2H2 (g)=CH 3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图 2 表示 2 mol H2(g)所具有的能量比 2 mol气态水所具有的能量多 483.6 kJ | |
| C. | 1 mol NaOH 分别和 1 mol CH3COOH、1 mol HNO3 反应,后者比前者△H 小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
分析 A.该反应是放热反应,△H为负值;
B.应为反应物的总能量大于生成物的总能量;
C.弱酸的电离是吸热过程;
D.汽油燃烧时产生热和光.
解答 解:A.该反应是放热反应,△H为负值,△H1=(a-b)kJ•mol-1,故A错误;
B.图2表示2 mol H2(g)和1molO2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ,故B错误;
C.弱酸的电离是吸热过程,后者比前者△H小,故C正确;
D.汽油燃烧时产生热和光,将化学能转化为热能和光能,故D错误.
故选C.
点评 本题考查常见的能量转化形式、吸热反应和放热反应,题目难度不大,注意汽油燃烧时产生热和光.

练习册系列答案
相关题目
8.短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示.下列说法正确的是( )
| X | Y | ||||
| Z | W | Q | |||
| A. | 工业上通过电解熔融Z2Y3制备单质Z | |
| B. | 元素Z的氧化物只能与强酸反应 | |
| C. | 原子半径的大小顺序为:rX<rY | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
15.已知下列热化学方程式
2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ/mol
CH4(g)+2O2(g)=2H2O (l)+CO2(g)△H=-890.3kJ/mol
1g 氢气和1g 甲烷分别燃烧后,放出的热量之比最接近( )
2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ/mol
CH4(g)+2O2(g)=2H2O (l)+CO2(g)△H=-890.3kJ/mol
1g 氢气和1g 甲烷分别燃烧后,放出的热量之比最接近( )
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.3:1 | D. | 4.6:1 |
5.下列溶液中的NO3-离子浓度与500mL l mol•L-1NaNO3中的NO3-浓度相等的是( )
| A. | 100mL2mol•L-1NH4NO3溶液 | B. | 40mL0.5mol•L-1Ca(NO3)2溶液混合 | ||
| C. | 50mLl.5mol•L-1Al(NO3)3溶液 | D. | 150mL1mol•L-1Mg(NO3)2溶液 |
12.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18 | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
9.下列说法正确的是( )
| A. | 第三周期非金属元素的含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从上到下依次减弱 | |
| C. | 在ⅥA族元素的氢化物(H2R)中,沸点最高的一定是无毒的 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点也一定越高 |