题目内容
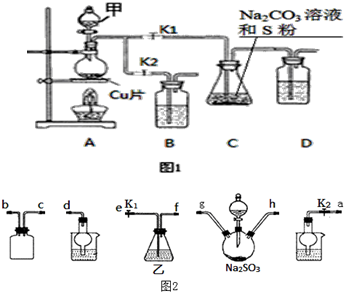
4.(制备型实验题)Na2S2O3?5H2O在化学定量分析中常用作基准物质,实验室制备原理为2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2.现设计如下装置(夹持仪器省略)进行实验.
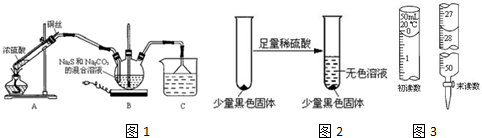
(1)A中发生反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)C中所盛试剂可能是NaOH溶液;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是将铜丝抽离液面停止反应.
(3)甲同学在加热A后,发现液面下的铜丝变黑.该同学对黑色生成物提出如下假设:
①可能是CuO; ②可能是Cu2O; ③可能是CuS
乙同学认为假设②一定不成立,依据是Cu2O是砖红色;该同学设计如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为CuS(填化学式).
(4)实验室用Na2S2O3标准溶液测定废水中Ba2+的浓度,过程如下:(已知:2S2O32-+I2═S4O62-+2I-).
废水25.00mL$→_{过滤}^{足量K_{2}CrO_{4}溶液}$BaCrO4固体$→_{稀盐酸}^{过量HI}$I2、Cr3+、Ba2+、Cl-$\stackrel{Na_{2}S_{2}O_{3}溶液}{→}$终点
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式:2BaCrO4+16H++6I-═3I2+2Ba2++2Cr3++8H2O;
②若以淀粉为指示剂,则达到滴定终点时的现象是滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色;
③若Na2S2O3标准溶液的浓度为0.0030mol?L-1,消耗该Na2S2O3标准溶液的体积如图3所示,则废水中Ba2+的浓度为0.0011mol•L-1.
分析 (1)在加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,应该用碱性溶液吸收;还可以将Cu和浓硫酸分离;
(3)Cu2O为砖红色固体;根据图片知该黑色固体不溶于稀硫酸,不能是CuO;
(4)①BaCrO4和过量HI反应生成I2、Cr3+、Ba2+,该反应中Cr元素化合价由+6价变为+3价、I元素化合价由-1价变为0价;
②碘遇淀粉试液变蓝色;
③根据硫代硫酸钠的物质的量计算碘的物质的量,根据碘和钡离子之间的关系计算钡离子物质的量浓度.
解答 解:(1)在加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,应该用碱性溶液吸收,所以C可能是NaOH溶液;还可以将Cu和浓硫酸分离,即将铜丝抽离液面而停止反应,
故答案为:NaOH溶液;将铜丝抽离液面停止反应;
(3)Cu2O为砖红色,该固体为黑色,所以不可能是Cu2O;CuO属于碱性氧化物,能溶于稀硫酸,该黑色固体不溶于稀硫酸,所以不可能是CuO,只能是CuS,
故答案为:Cu2O是砖红色;CuS;
(4)①BaCrO4和过量HI反应生成I2、Cr3+、Ba2+,该反应中Cr元素化合价由+6价变为+3价、I元素化合价由-1价变为0价,转移电子数为6,离子反应方程式为2BaCrO4+16H++6I-═3I2+2Ba2++2Cr3++8H2O,故答案为:2BaCrO4+16H++6I-═3I2+2Ba2++2Cr3++8H2O;
②碘遇淀粉试液变蓝色,如果滴入最后一滴,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色;
③根据2S2O32-+I2=S4O62-+2I-得n(I2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×[(27.60-0.10)×10-3]L×0.0030mol•L-1=4.125×10-2mol/L,根据2BaCrO4+6H++16I-═3I2+2Ba2++2Cr3++8H2O得n(Ba2+)=$\frac{2}{3}$n(I2)=$\frac{2}{3}$×$\frac{1}{2}$×0.04125=0.0275mmol,c(Ba2+)=0.0275mmol÷25.00mL=0.0011mol?L-1,故答案为:0.0011mol•L-1.
点评 本题以硫及其化合物为载体考查氧化还原反应离子方程式的书写、方程式的计算、探究物质组成等知识点,侧重考查学生分析推断、计算及知识综合应用能力,难点是钡离子浓度计算,明确方程式中各个物理量之间的关系,题目难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ/mol
CH4(g)+2O2(g)=2H2O (l)+CO2(g)△H=-890.3kJ/mol
1g 氢气和1g 甲烷分别燃烧后,放出的热量之比最接近( )
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.3:1 | D. | 4.6:1 |
| A. | 1:9 | B. | 1:36 | C. | 1:8 | D. | 8:9 |

 ,
, ,
, ;
; ,
, .
.