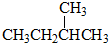题目内容
18.现有c(CH3COOH)=0.1mol/L的溶液,能使CH3COOH的电离平衡向右移动且能使c(CH3COO-)增大的是( )| A. | 加大量水稀释 | B. | 降低温度 | C. | 加少量NaOH | D. | 加少量CH3COONa |
分析 根据题意知,加入的物质和氢离子反应或升高温度才能使电离平衡向右移动且c(CH3COO-)增大,据此分析解答.
解答 解:A、加大量水稀释,能促进醋酸的电离,但CH3COO-的浓度减小,故A错误;
B、醋酸的电离是吸热反应,降低温度能抑制醋酸的电离,电离平衡逆向移动,故B错误;
C、加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,能促进醋酸的电离,使电离平衡向右移动且c(CH3COO-)增大,故C正确;
D、加少量CH3COONa,抑制醋酸的电离,电离平衡向左移动,故D错误;
故选C.
点评 本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.

练习册系列答案
相关题目
8. 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )| A. | 黄曲霉毒素M1的分子式为C17H14O7 | |
| B. | 黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基 | |
| C. | 1mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2molNaOH | |
| D. | 1mol黄曲霉毒素M1最多能与7molH2发生加成反应 |
6.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便.下列各组物质中,符合“氧化物-酸-碱-盐”顺序排列的是( )
| A. | H2O HNO3 NaOH KNO3 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2SO4 HCl Mg(OH)2 MgCl2 | D. | SO3 NaHCO3 NaOH Na2SO4 |
3.丁香油酚的结构如图示,从结构简式可推测化学性质叙述不正确的是( )


| A. | 可跟NaHCO3溶液反应放出CO2气体,又可使酸性KMnO4溶液褪色 | |
| B. | 可与三氯化铁溶液发生显色反应,又可与浓溴水发生取代反应 | |
| C. | 可与H2在一定条件下发生加成反应,又可与H2O在一定条件下发生加成反应 | |
| D. | 可与CH3COOH在稀硫酸作用下发生酯化反应,又可在稀硫酸作用下发生水解反应 |
7.下列反应中的氨的作用与4NH3+5O2→4NO+6H2O中氨的作用相同的是( )
| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | 3SiH4+4NH3=Si3N4+12H2 | ||
| C. | NH3+HCl=NH4Cl | D. | 2NH3+3CuO=3Cu+N2+3H2O |

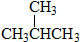 和
和 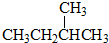
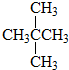 和
和