题目内容
6.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便.下列各组物质中,符合“氧化物-酸-碱-盐”顺序排列的是( )| A. | H2O HNO3 NaOH KNO3 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2SO4 HCl Mg(OH)2 MgCl2 | D. | SO3 NaHCO3 NaOH Na2SO4 |
分析 氧化物是两种元素组成,其中一种是氧元素的化合物;酸是电离出的阳离子全部是氢离子的化合物,碱是电离出的阴离子全部是氢氧根离子的化合物;盐是电离出金属阳离子和酸根阴离子的化合物,据此回答.
解答 解:A、H2O、HNO3、NaOH、KNO3符合“氧化物-酸-碱-盐”顺序,故A正确;
B、CO2、H2CO3、Na2CO3、Ca(HCO3)2分别属于氧化物、酸、盐、盐,故B错误;
C、H2SO4、HCl、Mg(OH)2、MgCl2分别属于酸、酸、碱、盐,故C错误;
D、SO3、NaHCO3、NaOH、Na2SO4分别属于氧化物、盐、碱、盐,故D错误.
故选A.
点评 本题考查学生物质的分类以及氧化物、酸、碱、盐的概念的理解和应用知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
16.利用海洋资源获得的部分物质如图所示,有关说法正确的是( )

| A. | 在化学反应中,${\;}_{1}^{1}$H2O可转变为D2O | |
| B. | “加碘食盐”生产中碘添加剂为单质I2 | |
| C. | 实验室用带玻璃塞的棕色瓶贮存液Br2 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
14.常温,将100mL0.001mol/L的盐酸和50mLpH=3的硫酸溶液混合,所得溶液的pH为(混合过程溶液体积的变化忽略不计)( )
| A. | 2.7 | B. | 3.0 | C. | 4.5 | D. | 3.3 |
1.下列大小关系的比较错误的是( )
| A. | pH相同的盐酸和醋酸加水稀释相同倍数后,pH前者大于后者 | |
| B. | 等质量的固态硫与硫蒸汽完全燃烧的反应热(△H),前者大于后者 | |
| C. | 温度、容积不变的密闭容器中2NO2?N2O4反应达到平衡,再充入N2O4气体,NO2的转化率前者大于后者 | |
| D. | 在相同条件下,2molH2和1molO2的能量的总和一定大于2mol水的能量的总和 |
18.现有c(CH3COOH)=0.1mol/L的溶液,能使CH3COOH的电离平衡向右移动且能使c(CH3COO-)增大的是( )
| A. | 加大量水稀释 | B. | 降低温度 | C. | 加少量NaOH | D. | 加少量CH3COONa |
15.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| B. | 常温常压下,1.7gH2O2中含有的电子数为0.8NA | |
| C. | 通常状况下,2.24LCO2和CO中所含分子数为0.1NA | |
| D. | 23gNO2和N2O4的混合气所含原子数为1.5NA |
 .
.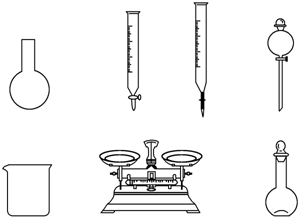 A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器