题目内容
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
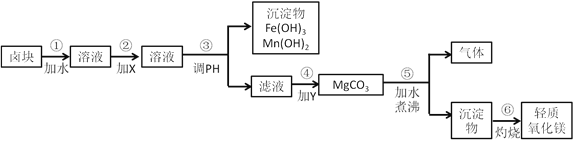
要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题。

(1)在步骤②中加入的试剂X,最佳的选择是______,其作用是__________;
(2)在步骤④中加入的试剂Y是_______________________;
(3)在步骤⑤中发生反应的化学方程式是_____________________________。
【答案】 漂液 将亚铁离子氧化成三价铁离子 碳酸钠 H2O+ MgCO3![]() Mg (OH) 2+CO2↑
Mg (OH) 2+CO2↑
【解析】(1)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3 沉淀而除之.虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故答案为:漂液(NaClO),使Fe2+氧化成为Fe3+;(2))步骤④的目的是将Mg2+从溶液中沉淀出来.从MgCl2制得MgO,有两种可行的方法,一种是向溶液中加入烧碱,另一种方法是向溶液中加入纯碱,此处选用后一种方法更合理.一方面,加烧碱生成的中间产物Mg(OH)2 是胶状沉淀,会造成过滤困难,更重要的是反应过程中不能进行轻化处理,只能得到重质氧化镁;加纯碱生成的中间产物MgCO3呈粗颗粒状,易过滤,MgCO3在水中经一段时间的加热会有部分反应生成CO2,由于CO2气体的产生,使沉淀变得疏松,灼烧沉淀后得到的是轻质氧化镁.另一方面,对比表2中烧碱和纯碱的价格可以看出,纯碱比烧碱价格低得多,采用纯碱路线既合理又经济,故答案为:纯碱(Na2CO3);(3)步骤⑤中反应的化学方程式为:H2O+MgCO3![]() Mg(OH)2 +CO2↑
Mg(OH)2 +CO2↑