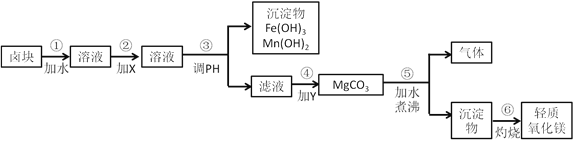
题目内容
【题目】Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l) ![]() CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
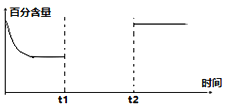
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。
【答案】 BC 小于 B容器的反应温度比A容器高,反应速率快,在相同时间内消耗掉CO多,而C容器中温度高,速率快,反应达到平衡后随温度上升平衡逆向移动,CO的量增大 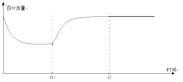 2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
【解析】(1)A.容器内气体只有二甲醚,相对分子质量一直保持不变,A错误;B.正反应体积增加,容器内气体压强不变说明反应达到平衡状态,B正确;C.相同时间内消耗甲醇的量是消耗二甲醚的两倍,说明正逆反应速率相等,达到平衡状态,C正确;D.甲醇和二甲醚物质的量相等不能说明正逆反应速率相等,所以不能证明达到了化学平衡状态,D错误,答案选BC。
(2)①B点温度高于A点,则A、B两点的速率大小v(A)<v(B)。②由于B容器的反应温度比A容器高,反应速率快,在相同时间内消耗掉CO多,而C容器中温度高,速率快,反应达到平衡后随温度上升平衡逆向移动,CO的量增大,因此曲线中CO的物质的量先减小后增大。(3)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,因此图象为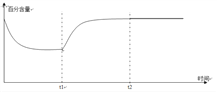 。(4)①根据装置图可知Pt(Ⅱ)电极产生S2O42-,发生得到电子的还原反应,反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒,生成硫酸根物质的量0.02mol/2=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol。
。(4)①根据装置图可知Pt(Ⅱ)电极产生S2O42-,发生得到电子的还原反应,反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒,生成硫酸根物质的量0.02mol/2=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol。