题目内容
13. 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是A.
A.向装置中充入O2 B.升高温度C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
②500℃时该反应的平衡常数K=1636.3.(保留1位小数.)
(3)恒温恒压,通入3mol SO2和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是CD.
A.第一次平衡时反应放出的热量为294.9kJ B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等 D.第二次平衡时SO3的体积分数等于$\frac{2}{9}$
(4)如果在500℃时向下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①平衡常数:K (甲)>K(丙) (填“>”、“<”或“=”下同),达到平衡时SO2的转化率:α(乙)>α(丙).
②达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体,甲容器的化学平衡逆向移动,乙容器的化学平衡不移动.(填“正向”、“逆向”或“不”)
分析 (1)A.向装置中充入O2,氧气浓度增大,反应速率加快,平衡正向移动;
B.正反应为放热反应,升高温度,平衡逆向移动;
C.向装置中充入N2,反应混合物各组分浓度不变,平衡不移动;
D.向装置中充入过量的SO2,二氧化硫转化率降低;
(2)①反应前4分钟,△n(O2)=$\frac{1}{2}$△n(SO3)=$\frac{1}{2}$×8mol=4mol,再根据v=$\frac{△c}{△t}$计算v(O2);
②6min到达平衡,平衡时三氧化硫为9.4mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):10 5 0
变化量(mol):9.4 4.7 9.4
平衡量(mol):0.6 0.3 9.4
再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数;
(3)保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),转化到方程式左边得到6mol SO2、4mol O2,与原平衡中起始物质的量均为3:2,恒温恒压下,为等效平衡,平衡时相同物质的含量、浓度相等.
A.恒温恒压下下,体积之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2(g)?2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 5-4.5=0.5
平衡量(mol):2 1.5 1
再结合热化学方程式计算放出的热量;
B.由A中计算可知,原平衡中二氧化硫的转化率为$\frac{1}{3}$,改变起始投入量,与原平衡为等效平衡,结合平衡时同种物质含量相等计算二氧化硫转化率;
C.两次平衡为等效平衡,平衡时同种物质的含量相等;
D.两次平衡为等效平衡,平衡时同种物质的含量相等,结合A中可知平衡时三氧化硫体积分数;
(4)①甲为恒温恒压,丙为恒容绝热,正反应为放热溶液,随反应进行丙中温度升高,升温平衡逆向移动,平衡常数减小;
乙为恒温恒容,等效为在丙的基础上降低温度,平衡正向移动;
②甲为恒温恒压,通入氩气,体积增大,混合物各组分浓度减小,等效为减小压强,平衡向气体体积增大方向移动;
乙为恒温恒容,通入氩气,混合物各组分浓度不变,平衡不移动.
解答 解:(1)A.向装置中充入O2,氧气浓度增大,反应速率加快,平衡正向移动,二氧化硫转化率增大,故A正确;
B.升高温度,反应速率加快,正反应为放热反应,平衡逆向移动,二氧化硫转化率减小,故B错误;
C.向装置中充入N2,反应混合物各组分浓度不变,平衡不移动,二氧化硫转化率不变,故C错误;
D.向装置中充入过量的SO2,反应速率加快,但二氧化硫转化率降低,故D错误,
故选:A;
(2)①反应前4分钟,△n(O2)=$\frac{1}{2}$△n(SO3)=$\frac{1}{2}$×8mol=4mol,则v(O2)=$\frac{\frac{4mol}{2L}}{4min}$=0.5mol/(L.min),
故答案为:0.5mol/(L.min);
②6min到达平衡,平衡时三氧化硫为9.4mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):10 5 0
变化量(mol):9.4 4.7 9.4
平衡量(mol):0.6 0.3 9.4
500℃时平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{(\frac{9.4}{2})^{2}}{(\frac{0.6}{2})^{2}×\frac{0.3}{2}}$=1636.3,
故答案为:1636.3;
(3)保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),转化到方程式左边得到6mol SO2、4mol O2,与原平衡中起始物质的量均为3:2,恒温恒压下,为等效平衡,平衡时相同物质的含量、浓度相等.
A.恒温恒压下下,体积之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2(g)?2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 5-4.5=0.5
平衡量(mol):2 1.5 1
故第一次平衡时反应放出的热量为196.6kJ×$\frac{1mol}{2mol}$=98.3 kJ,故A错误;
B.由A中计算可知,原平衡中二氧化硫的转化率为$\frac{1}{3}$,改变起始投入量,与原平衡为等效平衡,设平衡时二氧化硫转化为x,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):4 3.5 1
变化量(mol):4x 2x 2x
平衡量(mol):4-4x 3.5-x 1+2x
则$\frac{4-4x}{8.5-2x}$=$\frac{2}{4.5}$,解得x=$\frac{1}{14}$,二氧化硫的转化率减小,故B错误;
C.两次平衡为等效平衡,平衡时氧气体积分数相等,故C正确;
D.两次平衡为等效平衡,平衡时同种物质的含量相等,结合A中可知平衡时三氧化硫体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,故D正确,
故选:CD;
(4)①甲为恒温恒压,丙为恒容绝热,正反应为放热溶液,随反应进行丙中温度升高,升温平衡逆向移动,平衡常数减小,则K (甲)>K(丙),
乙为恒温恒容,等效为在丙的基础上降低温度,平衡正向移动,达到平衡时SO2的转化率:α(乙)>α(丙),
故答案为:>;>;
②甲为恒温恒压,通入氩气,体积增大,混合物各组分浓度减小,等效为减小压强,正反应为气体体积减小的反应,平衡逆向移动的;
乙为恒温恒容,通入氩气,混合物各组分浓度不变,平衡不移动,
故答案为:逆向;不.
点评 本题考查化学平衡计算与影响因素,(3)中注意利用等效思想解答,关键是构建平衡建立的途径,难度中等.

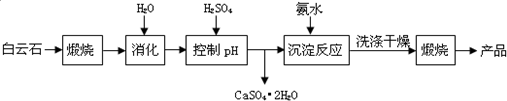
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:

①pH过高会导致镁浸出率降低,
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)该生产流程中还可得到的一种用途很大的副产品是硫酸铵.
| A. | 硫酸钡难溶于水,在水溶液中不能导电,所以硫酸钡不是电解质 | |
| B. | 强电解质在水溶液中的导电性一定比弱电解质强 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 硫酸、氢氧化钡、纯碱、苛性钠都是强电解质 |
①热稳定性:H2O>HF>H2S
②密度:K<Na<Rb
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④HCl的形成过程:

⑤元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑥结合质子的能力:S2->Cl-
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | ①②④⑤ | B. | ③⑤⑥⑦ | C. | ②④⑤⑥ | D. | ①③④⑦ |
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=2c(CO${\;}_{3}^{2-}$)+2c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O${\;}_{4}^{2-}$)+c(HC2O${\;}_{4}^{-}$)+c(OH-)=c(H+)+c(Cl-) |
| A. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |

 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤: