题目内容
1.工业上用白云石制备高纯氧化镁的工艺流程如图: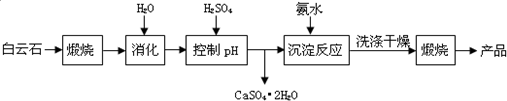
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:

①pH过高会导致镁浸出率降低,
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)该生产流程中还可得到的一种用途很大的副产品是硫酸铵.
分析 流程分析白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%,煅烧后加水,过滤可以除去铁和硅元素,滤液中加硫酸调节pH值,得到硫酸钙晶体沉淀,过滤后得滤液主要是硫酸镁溶液,加入氨水得氢氧化镁沉淀,同时得到硫酸铵溶液,氢氧化镁沉淀经洗涤、干燥、煅烧得高纯氧化镁,
(1)煅烧时应用坩埚加热固体,还需要泥三角进行操作;
(2)从图象可看出,随pH升高,会导致镁浸率降低;若pH太低,Fe2O3溶于H2SO4最终使产品混有杂质,且酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质;
(3)根据表中的数据可知,CaSO4的溶解度随温度升高而减小,且MgSO4的溶解度远远大于CaSO4的溶解度,据此答题;
(4)根据上面的分析可知,得到氢氧化镁沉淀的同时还得到硫酸铵,据此答题.
解答 解:流程分析白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%,煅烧后加水,过滤可以除去铁和硅元素,滤液中加硫酸调节pH值,得到硫酸钙晶体沉淀,过滤后得滤液主要是硫酸镁溶液,加入氨水得氢氧化镁沉淀,同时得到硫酸铵溶液,氢氧化镁沉淀经洗涤、干燥、煅烧得高纯氧化镁,
(1)煅烧时应用坩埚加热固体,还需要泥三角进行操作,故BC;
(2)从图象可看出,随pH升高,会导致镁浸率降低,镁纯度升高,若pH太低,Fe2O3溶于H2SO4最终使产品混有杂质,且酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质,故选AC,
故答案为:①镁浸出率降低;②AC;
(3)根据表中的数据可知,CaSO4的溶解度随温度升高而减小,且MgSO4的溶解度远远大于CaSO4的溶解度,所以从溶液中析出CaSO4•2H2O的操作步骤是升温结晶、趁热过滤,
故答案为:升温结晶、趁热过滤;
(4)根据上面的分析可知,得到氢氧化镁沉淀的同时还得到硫酸铵,
故答案为:硫酸铵.
点评 本题是一道关于物质的分离以及提纯知识的化学实验方案设计题,考查学生分析和解决问题的能力,难度不大,围绕实验目的,结合题给信息利用实验基础知识回答.

 阅读快车系列答案
阅读快车系列答案| A. | 新制的氯水呈浅黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分多,而久置的氯水所含成分少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
| A. | 实验使用的主要仪器是分液漏斗 | |
| B. | 溶质溶于萃取剂中所得的溶液不一定有颜色 | |
| C. | 溶质在萃取剂中的溶解度比在原溶剂中的溶解度大 | |
| D. | CCl4、苯、汽油、酒精均可萃取碘水中的碘 |
| A. | 18g H2O中含有的质子数为10NA | |
| B. | 标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是A.
A.向装置中充入O2 B.升高温度C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
②500℃时该反应的平衡常数K=1636.3.(保留1位小数.)
(3)恒温恒压,通入3mol SO2和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是CD.
A.第一次平衡时反应放出的热量为294.9kJ B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等 D.第二次平衡时SO3的体积分数等于$\frac{2}{9}$
(4)如果在500℃时向下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①平衡常数:K (甲)>K(丙) (填“>”、“<”或“=”下同),达到平衡时SO2的转化率:α(乙)>α(丙).
②达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体,甲容器的化学平衡逆向移动,乙容器的化学平衡不移动.(填“正向”、“逆向”或“不”)